网址:http://m.1010jiajiao.com/timu_id_4424317[举报]
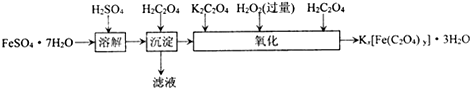
(1)若用铁和稀硫酸制备FeSO?7H2O,常保持
(2)上述流程中,“沉淀”一步所得Fe(C2O4)?2H2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O
2- 4 |

步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L-1HCl 10mol,加热至70~80℃,趁热用SnCl2-TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10mL,在75~80℃下用0.01000mol?L-1 KMnO4标准溶液滴定至终点(Cl- 不参与反应),将C2O
2- 4 |
步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的
②步骤2中MnSO4溶液的作用是
③在不增加试剂种类的前提下,步骤3的目的是
天然气(主要成分是甲烷)是一种清洁、高效的能源,现在许多城市家庭用于厨房使用的燃料已经由煤气(主要成分是H2和CO按体积比1︰1混合的气体混合物)换成了天然气;此外天然气也是很好的燃料电池的燃料,甲烷在燃料电池中的能量转换率可达到85%—90%。请回答下列问题:
(1)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(2)如果以该燃料电池为电源、石墨作两极电解饱和食盐水,则该电解过程中阳极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12,则理论上消耗甲烷在标准状况下的体积为: mL。
(3)将(2)中电解结束后的溶液取出,向其中加入含有Mg2+和Fe2+的溶液甲,Mg(OH)2和Fe(OH)2同时生成,已知Mg(OH)2和Fe(OH)2在该温度下的溶度积常数分别是2×10—11和8×10—16,则甲溶液中Mg2+和Fe2+的浓度之比为: 。
将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯。下列说法错误的是( )
A.ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式
B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
C.聚全氟乙丙烯分子的结构简式可能为
D.四氟乙烯中既含有极性键又含有非极性键
查看习题详情和答案>>
天然气(主要成分是甲烷)是一种清洁、高效的能源,现在许多城市家庭用于厨房使用的燃料已经由煤气(主要成分是H2和CO按体积比1︰1混合的气体混合物)换成了天然气;此外天然气也是很好的燃料电池的燃料,甲烷在燃料电池中的能量转换率可达到85%—90%。请回答下列问题:
(1)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(2)如果以该燃料电池为电源、石墨作两极电解饱和食盐水,则该电解过程中阳极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12,则理论上消耗甲烷在标准状况下的体积为: mL。
(3)将(2)中电解结束后的溶液取出,向其中加入含有Mg2+和Fe2+的溶液甲,Mg(OH)2和Fe(OH)2同时生成,已知Mg(OH)2和Fe(OH)2在该温度下的溶度积常数分别是2×10—11和8×10—16,则甲溶液中Mg2+和Fe2+的浓度之比为: 。
查看习题详情和答案>>