摘要:书写热化学方程式注意事项: a. 注明反应的温度和压强(若在101kPa和298K条件下进行.可不予注明).注明△H的“+ 与“- .放热反应为“- .吸热反应为“+ . b. △H写在方程式右边.并用“, 隔开. c. 必须标明物质的聚集状态(气体用“g .液体用“l .固体用“s .溶液用“aq ).若用同素异形体要注明名称. d. 各物质前的计量系数不表示分子数目只表示物质的量的关系.△H与计量数成正比关系.同样的反应.计量系数不同.△H也不同.例如: 2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ·mol-1 H2(g)+O2(g)=H2O(g),△H=-241.8kJ·mol-1 上述相同物质的反应.前者的△H是后者的两倍. 燃烧热和中和热:在101kPa时.1mol物质完全燃烧生成稳定的氧化物时所放出的热量.叫做该物质的燃烧热.在稀溶液里.酸跟碱发生中和反应而生成1mol 液态H2O.这时的反应热叫做中和热.燃烧热的热化学方程式强调燃烧物前的计量数为1.中和热强调热化学方程式中水前的计量数为1.燃烧热要强调生成稳定的氧化物.如:生成液态水. 如:H2的燃烧热的热化学方程式:H2(g)+O2(g)=H2O(l),△H=-286kJ·mol-1 中和热的热化学方程式: NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l),△H=-57.3kJ·mol-1
网址:http://m.1010jiajiao.com/timu_id_4422785[举报]
(1)市场上出售含碘盐的包装袋上明确写明“煮好菜后下盐保持碘效及防潮、防热、避光贮存”.请你根据碘元素在自然界中的分布、存在形式以及有关性质对说明书的注意事项加以评论.已知碘化物的某些性质如下表:
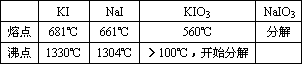
(2)请设计两种试纸,方便准确地检验含碘盐中的碘,并写出检验的操作及反应的离子方程式.
(3)由于KI易被空气中的氧气氧化成单质碘,口感苦涩,故含碘食盐中所加的是碘酸钾(KIO3).在酸性条件下,![]() 能将I-氧化成I2,I2遇淀粉试液变蓝.根据此原理,甲、乙两同学用各自准备的药品检验同一市售食盐,确定是含碘盐还是无碘盐.
能将I-氧化成I2,I2遇淀粉试液变蓝.根据此原理,甲、乙两同学用各自准备的药品检验同一市售食盐,确定是含碘盐还是无碘盐.
甲同学将适量食盐溶于配制好的KI溶液中,然后加淀粉溶液,溶液不变色,甲认为该食盐为无碘盐.
乙同学将适量食盐溶于配制好的KI溶液中,加稀硫酸,再加淀粉溶液,溶液呈蓝色,乙认为该食盐为含碘盐.
你认为甲、乙两同学依据实验所作的结论________.
A.甲正确
B.乙正确
C.无法判断谁正确
理由是________.