网址:http://m.1010jiajiao.com/timu_id_442083[举报]
前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等。
(1)有机颗粒物的产生主要是由于不完全燃烧导致的相关热化学方程式如下:
①C(s)+O2(g)=CO2(g) ΔH1=-94kJ·mol-1;
②C8H16(l)+12O2(g)=8CO2(g)+8H2O(l)? ΔH2=-1124kJ·mol-1
③C8H16(l)+4O2=8C(g)+8H2O(l)ΔH3=????????????????? kJ·mol-1
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是:????????????? ????????????? ????????????? ????????????? ;通过质谱仪发现还有多种副反物,其中之一为: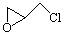 ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(3)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(4)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
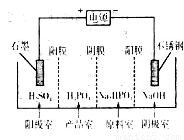
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看习题详情和答案>>
 (2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.(l)目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为
②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
a.
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v正(CO2)=v逆(H2O)
(4)图2表示该反应此流程的第Ⅱ步反应在时刻t1达到平衡、在时刻t2分别因改变某个条件而发生变化的情况:图中时刻t2发生改变的条件是
(5)若400℃时,第Ⅱ步反应生成1mol氢气的热量数值为33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:
CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3kJ?mol-1.
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式
| ||
| ||
(2)装置A中g管的作用是
装置E中的h瓶需要冷却的理由是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是