网址:http://m.1010jiajiao.com/timu_id_442010[举报]

Ⅱ、烯烃与HBr发生加成时,不同的条件下有不同的反应方式:

化合物L是由某一卤代烃A经过下列一系列变化合成的:

上述物质中,A、H、J是同分异构体,H分子中除卤素原子外,还含有一个“C6H5-”、两个“-CH3”、一个“-CH2”、一个“
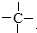 ”,且当两“-CH3”上的H再被一个同种卤素原子取代成为二卤代烃时,只能得到一种结构.回答下列问题:
”,且当两“-CH3”上的H再被一个同种卤素原子取代成为二卤代烃时,只能得到一种结构.回答下列问题:(1)写出结构简式:H:
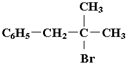

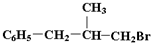
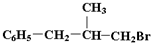
(2)在A~L物质中,除A、H、J一组外,还有属于同分异构体的一组物质是
(3)在A~L物质中,能发生银镜反应的是


(4)反应(11)的类型为
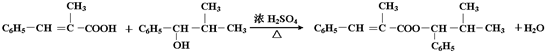
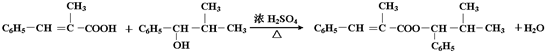

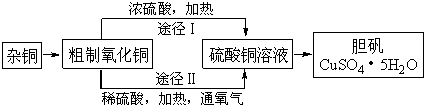
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径II有明显的两个优点是:
(5)在测定所得胆矾(CuSO4?xH2O)中结晶水x值的实验过程中,若测定结果x 值偏高,可能的原因是
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化.
由C、H、O三种元素组成的有机物A,相对分子质量104。将0.1molA充
分燃烧后,将产物依次通入足量浓硫酸和氢氧化钠溶液,浓硫酸增重7.2g,氢氧化钠溶
液增重17.6g。
回答下列问题:
(1)有机物A的分子式是 。
(2)A能与钠反应,也能与碳酸氢钠反应。A中含有的官能团的名称是 。
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B。写出化学方程式
。
(4)A与浓酸共热还可以生成一种能使Br2的四氯化碳溶液褪色的化合物C。写出A生成C的化学方程式 。
反应类型 。
利用C可以合成高分子化合物D,D的结构简式是 。
(5)A的一种同分异构体E,经测定分子结构中含有一个—CH3,两个—CH—;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式
。
查看习题详情和答案>>回答下列问题:
(1)有机物A的分子式是________________。
(2)A能与钠反应,也能与碳酸氢钠反应。A中含有的官能团的名称是________________。
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B。写出化学方程式:________________________________。
(4)A与浓硫酸共热还可以生成一种能使Br2的四氯化碳溶液褪色的化合物C。写出A生成C的化学方程式:________________________________,反应类型是________________。
利用C可以合成高分子化合物D,D的结构简式是________________。
(5)A的一种同分异构体E,经测定分子结构中含有一个—CH3,两个![]() ;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式:________________。
;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式:________________。