摘要:11.2g含Cu.Al.Ca.Mg中一种或几种杂质的铁块.与足量稀H2SO4反应.完全反应后收集到0.4g氢气.则铁块中一定含有杂质是( ) A.Al B.Mg C.Ca D.Cu
网址:http://m.1010jiajiao.com/timu_id_4418909[举报]
甲、乙两位同学在学习甲烷性质时,发现甲烷与氢气和一氧化碳性质上有很多相似之处,如密度比空气小,难溶于水,具有可燃性等.但H2和CO具有还原性,那么甲烷有没有还原性呢?
【假设猜想】甲同学:甲烷没有还原性
乙同学:甲烷有还原性,并对甲烷还原氧化铜的产物提出了下列假设:
假设1:Cu、CO2
假设2:Cu、CO、H2O
假设3:Cu、CO2、H2O
假设4:Cu、CO、CO2、H2O
其中假设
【查阅资料】无水硫酸铜遇水由白色变为蓝色
【设计实验步骤】(假设药品都是足量的)为了判断假设的合理性,乙同学设计了以下装置
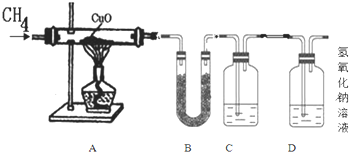
①分别称量装置A、B、C的质量
②再次分别称量装置A、B、C的质量
③向玻璃管中装入CuO通一段时间的CH4
④停止加热,继续通入CH4至冷却到室温
⑤缓缓通入足量的CH4,加热装置A,使其充分反应
甲同学认为还缺少一个步骤,缺少的步骤是⑥
【进行实验】乙同学按照正确的步骤进行实验,并记录了实验现象和数据
①装置A中的黑色粉末变红;装置B中白色粉末变蓝;装置C中石灰水变浑浊
②称量数据如表所示.
【现象分析与数据处理】
根据装置A、B、C中的现象可推知,CH4与CuO充分反应后的产物依次是
【实验结论】
①CH4
②装置A中发生的反应方程式为
查看习题详情和答案>>
【假设猜想】甲同学:甲烷没有还原性
乙同学:甲烷有还原性,并对甲烷还原氧化铜的产物提出了下列假设:
假设1:Cu、CO2
假设2:Cu、CO、H2O
假设3:Cu、CO2、H2O
假设4:Cu、CO、CO2、H2O
其中假设
1
1
不合理,理由是甲烷中含有氢元素
甲烷中含有氢元素
【查阅资料】无水硫酸铜遇水由白色变为蓝色
【设计实验步骤】(假设药品都是足量的)为了判断假设的合理性,乙同学设计了以下装置

①分别称量装置A、B、C的质量
②再次分别称量装置A、B、C的质量
③向玻璃管中装入CuO通一段时间的CH4
④停止加热,继续通入CH4至冷却到室温
⑤缓缓通入足量的CH4,加热装置A,使其充分反应
甲同学认为还缺少一个步骤,缺少的步骤是⑥
检查装置的气密性
检查装置的气密性
,其合理的操作顺序是⑥①③⑤④②
⑥①③⑤④②
(填序号).【进行实验】乙同学按照正确的步骤进行实验,并记录了实验现象和数据
①装置A中的黑色粉末变红;装置B中白色粉末变蓝;装置C中石灰水变浑浊
②称量数据如表所示.
| A中玻璃管(含药品)质量 | 装置B的质量 | 装置C的质量 | |
| 反应前 | 150g | 156.6g | 256.8g |
| 反应后 | 147.2g | 158.4g | 257.9g |
根据装置A、B、C中的现象可推知,CH4与CuO充分反应后的产物依次是
Cu H2OCO2
Cu H2OCO2
.【实验结论】
①CH4
有
有
(填“有”或“没有”)还原性.如没有,不作答;如有,则乙同学的假设4
4
正确,原因是根据质量守恒定律,生成的二氧化碳中碳元素的质量为0.3g,生成的水中氢元素的质量为0.2g,C:H=3:2而甲烷中C:H=4:1,因此还生成CO.
根据质量守恒定律,生成的二氧化碳中碳元素的质量为0.3g,生成的水中氢元素的质量为0.2g,C:H=3:2而甲烷中C:H=4:1,因此还生成CO.
②装置A中发生的反应方程式为
2CH4+7CuO
7Cu+4H2O+CO+CO2
| ||
2CH4+7CuO
7Cu+4H2O+CO+CO2
.
| ||