摘要:23.(2009·浙江杭州高三第一次质检)在一定温度下有甲.乙两容积相等的容器. (1)向甲容器中通入3 mol N2和4 mol H2.反应达到平衡时.生成NH3 amol.此时.NH3的物质的量分数是 .若在达到平衡状态的甲容器中通入少量的N2.则达到新平衡时.体系中N2的体积分数将 (选填“增大 .“减小 或“不变 ). (2)向乙中通入2mol NH3.欲使反应达到平衡时.各物质的浓度与(1)中第一次平衡时相同.则起始时还需通入 mol N2和 mol H2. (3)若起始时.向乙中通入6mol N2和8mol H2.达到平衡时.生成的NH3的物质的量为b mol. (选填“> .“< 或“= ).
网址:http://m.1010jiajiao.com/timu_id_4411895[举报]
(6分)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能. 已知部分化学键的键能如下:
| 化学键 | N—H | N—N | O==O | N≡N | O—H |
| 键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
(2)为了提高肼(N2H4)燃烧过程中释放的能量,常用二氧化氮作氧化剂代替氧气,这两者反应生成氮气和水蒸气.且:
①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol
试写出肼和NO2完全反应的热化学方程式:____________________________________
(3)随着中国空间技术的发展,中俄于2009年携手探火星工程,寻找更高效的火箭推进剂也被提到了议事日程.在实验室我国科研人员应用电子计算机模拟出具有高能量的物质N60,它的结构与C60十分相似.已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有________个N—N键. 查看习题详情和答案>>
(2009?黄浦区二模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
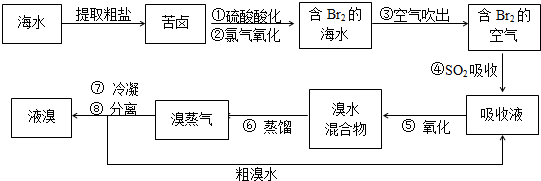
(1)溴在元素周期表中位于
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是
(3)步骤④的离子方程式:
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:
(5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是
查看习题详情和答案>>

(1)溴在元素周期表中位于
第四
第四
周期,VIIA
VIIA
族.(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是
酸化可抑制Cl2、Br2与水反应
酸化可抑制Cl2、Br2与水反应
.(3)步骤④的离子方程式:
Br2+SO2+2H2O=4H++2Br-+SO42-
Br2+SO2+2H2O=4H++2Br-+SO42-
.(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气随水排出去,溴气中水分增加;温度过低,溴不能完全蒸出,吸收率低
温度过高,大量水蒸气随水排出去,溴气中水分增加;温度过低,溴不能完全蒸出,吸收率低
.(5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
分液漏斗
分液漏斗
,分离时液溴从分离器的下口
下口
(填“上口”或“下口”)排出.(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是
氧化后的海水虽然含有溴单质,但浓度低;如果直接蒸馏原料,产品成本高
;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
氧化后的海水虽然含有溴单质,但浓度低;如果直接蒸馏原料,产品成本高
;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
.;“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程.
(2009?深圳二模)I、(1)下列实验操作或实验问题处理方法中,正确的是
A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.酒精灯洒漏少量酒精着火,用湿布盖灭
C.实验剩余的NaOH放回原试剂瓶
D.在容量瓶中加入一定体积的水再加入浓硫酸,配置准确浓度的稀硫酸
E.知趣乙酸乙酯时,加热前应先向试管中加入碎瓷片
II、无水氯化铝为白色粉末,极易吸水,常压下182.7℃升华.学生甲拟选用如图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝.
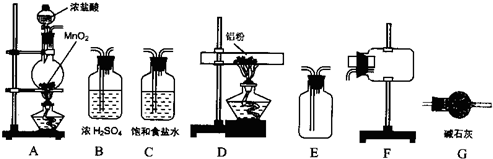
回答下列问题
(2)实验前,如何检查装置A的气密性
(3)装置A中反应的化学方程式为
(4)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为:
A→
(5)装置G的作用是
(6)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧的到无水氯化铝.请你评价该方案是否可行,并说明理由
查看习题详情和答案>>
ABE
ABE
(填序号)A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.酒精灯洒漏少量酒精着火,用湿布盖灭
C.实验剩余的NaOH放回原试剂瓶
D.在容量瓶中加入一定体积的水再加入浓硫酸,配置准确浓度的稀硫酸
E.知趣乙酸乙酯时,加热前应先向试管中加入碎瓷片
II、无水氯化铝为白色粉末,极易吸水,常压下182.7℃升华.学生甲拟选用如图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝.

回答下列问题
(2)实验前,如何检查装置A的气密性
关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水.然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水.然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
.(3)装置A中反应的化学方程式为
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
| ||
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
.
| ||
(4)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为:
A→
C
C
→B
B
→D
D
→F
F
→G(5)装置G的作用是
吸收多余的氯气,同事防止空气中水蒸气进入到装置中使氯化铝水解
吸收多余的氯气,同事防止空气中水蒸气进入到装置中使氯化铝水解
.(6)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧的到无水氯化铝.请你评价该方案是否可行,并说明理由
不可行,AlCl3在水中存在如下平衡:AlCl3+3H2O=Al(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3=Al2O3+3H2O↑,因此固体产物主要为Al2O3
不可行,AlCl3在水中存在如下平衡:AlCl3+3H2O=Al(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3=Al2O3+3H2O↑,因此固体产物主要为Al2O3
. (2009?湖北模拟)现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:
(2009?湖北模拟)现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:(1)C的原子结构示意图为
Cl

Cl
;B在周期表中的位置是
第三周期第IIIA族
第三周期第IIIA族
.(2)用电子式表示AC的形成过程


(3)写出B单质与NaOH溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(4)电浮选凝聚法是工业上采用的一种污水处理方法,右图是该方法处理污水的实验装置示意图(B、D金属单质作电极).实验过程中,污水的pH始终保持在5.0~6.0之间.接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用.阳极的电极反应有两个,分别是2H2O-4e-=4H++O2↑和
Fe-2e-=Fe2+
Fe-2e-=Fe2+
.阳极区生成沉淀的离子方程式是4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
.(5)一定条件下,2mol B与3mol D的氧化物W恰好反应,则W的化学式
FeO
FeO
.(2009?上海)尼龙-66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如下图所示(中间产物E给出了两条合成路线).
已知:R-Cl
R-CN
R-CH2NH2
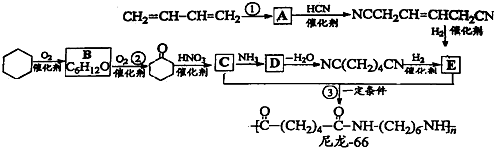
完成下列填空:
(1)写出反应类型:反应②
(2)写出化合物D的结构简式:
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:
 ;
;
(4)写出反应①的化学方程式:
(5)下列化合物中能与E发生化学反应的是
a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):
 .
.
查看习题详情和答案>>
已知:R-Cl
| HCN |
| 催化剂 |
| H2 |
| 催化剂 |

完成下列填空:
(1)写出反应类型:反应②
氧化反应
氧化反应
,反应③缩聚反应
缩聚反应
;(2)写出化合物D的结构简式:
NH4OOC(CH2)4COONH4
NH4OOC(CH2)4COONH4
;(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:


(4)写出反应①的化学方程式:
CH2=CH-CH=CH2+Cl2→CH2ClCH=CHCH2Cl
CH2=CH-CH=CH2+Cl2→CH2ClCH=CHCH2Cl
;(5)下列化合物中能与E发生化学反应的是
d
d
.a.NaOH b.Na2CO3 c.NaCl d.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):

