摘要:5.(2009·山东省烟台市高三模块检测)某化学科研小组研究在其他条件不变时.改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响.得到如下图所示的变化规律(图中T表示温度.n表示物质的量).根据图示得出的判断结论正确的是 ( ) A.反应速率a>b>c B.达到平衡时A2的转化率大小为:b>a>c C.若T2>T1.则正反应是放热反应 D.达到平衡时.AB3的物质的量大小为:c>b>a
网址:http://m.1010jiajiao.com/timu_id_4411877[举报]
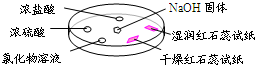 (2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( ) (2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )
|
查看习题详情和答案>>
(2009?宿迁模拟)金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航海、化工、医疗上不可缺少的材料.为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示.

请回答下列问题:
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式
(2)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,试写出该反应的化学方程式:
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②
Ti(s)+Cl2(g)=
TiCl4(l)△H=-385kJ?mol-1
则Mg 与TiCl4反应的热化学方程式为
(4)在上述产业链中,合成96t 甲醇理论上需额外补充H2
查看习题详情和答案>>

请回答下列问题:
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式
2FeTiO3+6C+7Cl2═2FeCl3+2TiCl4+6CO
2FeTiO3+6C+7Cl2═2FeCl3+2TiCl4+6CO
.(2)TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,试写出该反应的化学方程式:
TiCl4+3H2O═H2TiO3+4HCl
TiCl4+3H2O═H2TiO3+4HCl
.(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②
| 1 |
| 2 |
| 1 |
| 2 |
则Mg 与TiCl4反应的热化学方程式为
2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)△H=-512kJ?mol-1
2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)△H=-512kJ?mol-1
,该反应在氩气氛中进行的理由是Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
.(4)在上述产业链中,合成96t 甲醇理论上需额外补充H2
5
5
t (不考虑生产过程中物质的任何损失).(2009?揭阳二模)某白色粉末可能含有K2SO4、NH4Cl、NaCl.请设计合理实验探究该白色粉末的组成.
限选实验仪器与试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、1mol?L-1硫酸、1mol?L-1硝酸、1mol?L-1盐酸、2mol?L-1NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水.
完成以下实验探究过程:
(1)提出假设:
根据题意,该白色粉末的组成有
(2)设计实验方案
基于该粉末中上述三种盐均存在这一假设,设计出实验方案(不要在答题卡上作答).
(3)根据②的实验方案,叙述实验操作、预期现象和结论.
查看习题详情和答案>>
限选实验仪器与试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、1mol?L-1硫酸、1mol?L-1硝酸、1mol?L-1盐酸、2mol?L-1NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水.
完成以下实验探究过程:
(1)提出假设:
根据题意,该白色粉末的组成有
7
7
种可能的情况.(2)设计实验方案
基于该粉末中上述三种盐均存在这一假设,设计出实验方案(不要在答题卡上作答).
(3)根据②的实验方案,叙述实验操作、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 步骤1: 用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管 用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管 |
白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl 白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl |
| 步骤2: 用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡 用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡 |
固体溶解得无色溶液 固体溶解得无色溶液 |
| 步骤3: 向试管B中滴加过量的Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置 向试管B中滴加过量的Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置 |
有白色沉淀生成,证明原白色粉末含有K2SO4 有白色沉淀生成,证明原白色粉末含有K2SO4 |
| 步骤4: 取试管B中上层清液少量于试管C中,滴加AgNO3溶液和1mol?L-1硝酸 取试管B中上层清液少量于试管C中,滴加AgNO3溶液和1mol?L-1硝酸 |
有白色沉淀生成,证明原白色粉末含有NaCl 有白色沉淀生成,证明原白色粉末含有NaCl |
| … | … … |
(2009?红桥区一模)A、B、C为单质,其中一种是金属,通常状况下,A为固体.B为液体(且主要从海水中提取),C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)
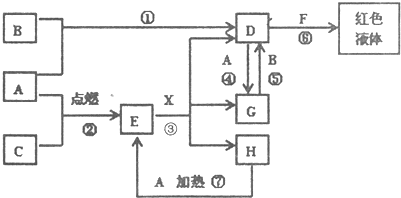
(1)写出:A的化学式
 .
.
(2)在反应①-⑦中,不属于氧化还原反应的是
(3)完成E和X反应的离子方程式:
(4)与B同族的元素中最高价氧化物的水化物其酸性最强的是
(5)完成H和某种化合物快速制C的化学方程式
(6)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
查看习题详情和答案>>

(1)写出:A的化学式
Fe
Fe
,F的化学式KSCN
KSCN
,H的电子式

(2)在反应①-⑦中,不属于氧化还原反应的是
③⑥
③⑥
(填序号).(3)完成E和X反应的离子方程式:
Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4+8H+=Fe2++2Fe3++4H2O
.(4)与B同族的元素中最高价氧化物的水化物其酸性最强的是
HClO4
HClO4
(填化学式)(5)完成H和某种化合物快速制C的化学方程式
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
,每生成0.15 mol C电子转移0.3
0.3
mol.(6)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:
3Br2+8NH3=6NH4Br+N2
3Br2+8NH3=6NH4Br+N2
.