摘要:考点1.金属矿物及铁的冶炼 :①概念:工业上把能用来提炼金属的矿物叫做矿石.②常见的矿石:赤铁矿(Fe2O3).黄铁矿(FeS2).菱铁矿(FeCO3).铝土矿(Al2O3).黄铜矿(CuFeS2).辉铜矿(Cu2S). (2)铁的冶炼:①原理:利用高温条件下.焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来.如用赤铁矿石炼铁的化学方程式为: .②原料:铁矿石.焦炭.石灰石及空气.③设备:高炉.④炼铁时选择铁矿石的标准:a.铁矿石中铁元素的质量分数大,b.炼铁过程中产物对空气不能造成污染,满足以上两个条件的矿石是理想的绿色矿石. 考点2.金属的腐蚀和防护 (1)铁生锈的条件:铁生锈的主要条件是与空气和水蒸气直接接触.铁制品锈蚀的过程.实际上是铁与空气中的氧气.水蒸气等发生复杂的化学反应.铁锈的主要成分是Fe2O3·xH2O. (2)铁的防锈:原理是隔绝空气或水.使铁失去生锈的条件.防锈措施:防止铁制品生锈.一是保持铁制品表面的洁净和干燥.二是在铁制品表面涂上一层保护膜.防止铁与氧气和水的反应.例如:①刷一层油漆,②涂上一层机油,③电镀一层不易生锈的金属.如镀锌等,④经加工使金属表面生成一层致密的氧化膜.如烤蓝,⑤在金属表面覆盖搪瓷.塑料等. 考点3.金属资源的保护 (1)矿物的储量有限.而且不能再生.(2)废旧金属的回收和利用可以减少对环境的污染.还可以节约金属资源.(3)保护金属资源的有效途径:①防止金属腐蚀,②回收利用废旧金属,③合理有效地开采矿物,④寻找金属的替代品. 第九单元 溶 液 第20讲 溶液及分类
网址:http://m.1010jiajiao.com/timu_id_4410467[举报]
设计从废水中回收硫酸亚铁固体和铜的实验方案如下: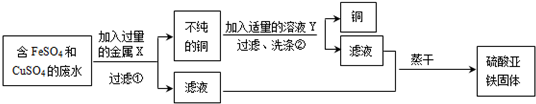
(1)金属X是
(2)写出上述实验方案中有关反应的化学方程式①
查看习题详情和答案>>

(1)金属X是
铁
铁
,溶液Y是稀硫酸
稀硫酸
(2)写出上述实验方案中有关反应的化学方程式①
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
②Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.甲、乙、丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下:
计算:
(1)金属混合物中铁的质量分数.
(2)该硫酸中溶质的质量分数.
查看习题详情和答案>>
| 甲 | 乙 | 丙 | |
| 取用金属混合物的质量(/g) | 10 | 10 | 20 |
| 取用稀硫酸的质量(/g) | 100 | 120 | 100 |
| 反应后过滤得到干燥固体的质量(/g) | 2 | 2 | 12 |
(1)金属混合物中铁的质量分数.
(2)该硫酸中溶质的质量分数.
有一份铁粉与铜粉混合物的样品,为了解其组成,某同学进行了如下实验,所得数据如下:
试计算:
(1)金属混合物中铁的质量分数.
(2)该稀硫酸中溶质质量分数. 查看习题详情和答案>>
| 实验 | 第一次 | 第二次 | 第三次 |
| 取用金属混合物的质量/g | 20 | 20 | 40 |
| 取用稀硫酸的质量/g | 200 | 250 | 200 |
| 金属混合物与稀硫酸反应 生成氢气的质量/g |
0.4 | 0.4 | 0.4 |
(1)金属混合物中铁的质量分数.
(2)该稀硫酸中溶质质量分数. 查看习题详情和答案>>
为了测出某铁粉和铜粉的混合物中铁粉的含量,小中同学按如下表取样做了3次实验,记录所得数据如下:
计算:(1)金属混合物中铁的质量为 g.
(2)该稀硫酸中溶质的质量分数. 查看习题详情和答案>>
| 次 数 | 1 | 2 | 3 |
| 金属混合物质量(g) | 10 | 10 | 20 |
| 稀硫酸质量(g) | 100 | 120 | 100 |
| 反应后,过滤得干燥固体质量(g) | 1.6 | 1.6 | 11.6 |
(2)该稀硫酸中溶质的质量分数. 查看习题详情和答案>>
 (2012?衡阳)将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答:
(2012?衡阳)将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答: