摘要: 把足量的铁粉投入到硫酸和CuSO4的混合溶液中.充分反应后.剩余金属的质量与原加入的铁粉的质量相等.则原溶液中[H+]与[SO42-]之比为 1:4 1:3 [简析]设原溶液H2SO4为Xmol.耗铁也是Xmol.CuSO4为Ymol.反应后金属的质量增加8Y克.所以必有56X=8Y.得n(H2SO4) : n(CuSO4)=1:7.所以[H+] : [SO42-]=1 : 4,故选(B)
网址:http://m.1010jiajiao.com/timu_id_4405581[举报]
把足量的铁粉投入到稀盐酸和氯化铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和Cl-的物质的量之比为( )
A.1∶4 B.1∶7 C.1∶8 D.2∶5
查看习题详情和答案>>
把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+和SO42-的物质的量浓度之比是( )
查看习题详情和答案>>
| A.2:7 | B.3:8 | C.1:2 | D.1:4 |
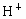 与
与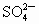 的物质的量之比为
的物质的量之比为