摘要:1.守恒法: 例1.由Mg(OH)2和MgO组成的混合物.测得其中含镁元素的质量分数为48%.取该混合物10g.将其投入110g的稀硫酸中恰好完全反应.所得溶液中溶质的质量分数为 ( ) A.12% B.24% C.20% D.30% 解析:根据在化学反应中Mg元素的质量守恒.建立Mg元素和MgSO4 的质量关系可求得反应后所得溶液中的溶质MgSO4的质量.即可求得所得溶液中溶质的质量分数. Mg - MgSO4 24 120 10g×48% =4.8g x
网址:http://m.1010jiajiao.com/timu_id_4405131[举报]
下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。

(1)铁的另两种常见物的化学式 、 。
(2)加水溶解过程中,实验室通常使的玻璃仪器有烧杯和 ,操作A的名称 。
(3)副产品P的名称 ,由溶液N获得该副产品的操作顺序(编号填写)b→ → →d.
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水.
(4)通空气时的化学方程式4Fe(OH)2+2H2O+O2═4Fe(OH)3,由M获得的过程中发生的反应为Fe(OH)2+2Fe(OH)3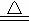 Fe3O4+4H2O,控制“一定量空气”的目的 。
Fe3O4+4H2O,控制“一定量空气”的目的 。
对氢氧化铜的再探究:同学们想探究能使氢氧化铜分解的最低温度到底是多少呢?于是他们又做了如下实验,采用了水浴加热,优点是
(1)由以上实验可知,温度越高,氢氧化铜分解速率
(2)由实验可知,氢氧化铜分解的最低温度应该在
(3)采取“半值法”能减少实验次数.以上实验若按“半值法”进行,就可以省略60℃、70℃、
拓展研究:将铜粉和碳粉的混合物在空气中充分灼烧后,最终得到黑色固体,其质量与原混合物的质量相等,则铜粉在原混合物中的质量分数是
查看习题详情和答案>>
能够均匀受热
能够均匀受热
.分别取2毫升10%氢氧化钠溶液和1毫升10%硫酸铜溶液混合于试管中生成蓝色沉淀后,将试管置于10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃的水中进行水浴观察实验现象,并将实验结果记录如下:| 产物变化情况 | 水浴温度 | ||||||||
| 0℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ | 90℃ | |
| 试管中蓝色沉淀变化情况 | 短时间内无变化 | 短时间内无变化 | 2分钟后有出现黑色沉淀 | 30秒后出现了黑色物质 | 10秒后出现了黑色物质 | 6秒后出现黑色物质 | 数秒后出现黑色物质 | 马上出现黑色物质 | 蓝色沉淀变黑更快 |
越快
越快
.(2)由实验可知,氢氧化铜分解的最低温度应该在
20℃~30℃
20℃~30℃
之间.(3)采取“半值法”能减少实验次数.以上实验若按“半值法”进行,就可以省略60℃、70℃、
80℃
80℃
和90℃
90℃
(填温度数值)的实验.(4)实验结束后,细心的甲同学发现他的试管中剩余的浊液未经加热,已经大部分变成了黑色.由此,他想到氢氧化铜不需加热,常温下也会缓慢分解.拓展研究:将铜粉和碳粉的混合物在空气中充分灼烧后,最终得到黑色固体,其质量与原混合物的质量相等,则铜粉在原混合物中的质量分数是
80%
80%
. (2012?江宁区一模)过氧化钙(CaO2)广泛应用于水产养殖、污水处理等领域,是优良的供养剂.
(2012?江宁区一模)过氧化钙(CaO2)广泛应用于水产养殖、污水处理等领域,是优良的供养剂.【制备CaO2】工业制备过氧化钙的一种方法是氢氧化钙法.
(1)Ca(OH)2和H2O2在有水存在的条件下生成CaO2?8H2O,它在120℃时完全分解为CaO2等.有关化学反应方程式为:
Ca(OH)2+H2O2+6H2O=CaO2?8H2O
Ca(OH)2+H2O2+6H2O=CaO2?8H2O
,CaO2?8H2O
CaO2+8H2O
| 120℃ |
CaO2?8H2O
CaO2+8H2O
.| 120℃ |
【测定CaO2纯度】CaO2在350℃时能迅速分解,生成CaO和O2.右图是实验室测定产品中CaO2含量的装置.
(2)检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差
不变
不变
,说明气密性良好.(3)正确读取量气管内液面的初始、最终读数前都需进行的操作是
调节两边液面相平
调节两边液面相平
.(4)加热小试管时,随着过氧化钙分解,量气管内的液面逐渐下降,为防止试管和量气管内气体压强过大,可将漏斗
下移
下移
(填“上提”或“下移”).(5)计算含量需要测定的数据有
AB
AB
.(填字母序号)A.氧气的体积 B.样品的质量 C.反应的时间
(6)若样品质量为0.20g,反应前量气管读数为2.10mL,反应后量气管读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量气管的最佳规格是
A
A
.(填字母序号)A.50mL B.100mL C.1L
(7)样品中CaO2含量为
72%
72%
.(8)若样品质量用w表示,反应前称量药品和小试管总质量为m g,反应后在空气中冷却,称量药品和小试管总质量为n g,则CaO2含量=
| 9m-n |
| 2w |
在空气中冷却导致CaO吸收水蒸气
在空气中冷却导致CaO吸收水蒸气
.某化学小组同学,用如图所示实验探究质量守恒定律.

(1)充分反应冷却后,天平仍然平衡的是
(2)由上述实验可知,在化学反应前后,一定不变的
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质总质量
(3)本实验中,若药品和砝码位置放颠倒了,充分反应冷却后,天平仍然平衡的是
查看习题详情和答案>>

(1)充分反应冷却后,天平仍然平衡的是
A
A
(填“A”或“B”),该反应的化学方程式为4P+5O2
2P2O5
| ||
4P+5O2
2P2O5
.
| ||
(2)由上述实验可知,在化学反应前后,一定不变的
①②⑤⑥
①②⑤⑥
(填数字序号). ①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质总质量
(3)本实验中,若药品和砝码位置放颠倒了,充分反应冷却后,天平仍然平衡的是
A
A
(填“A”或“B”),不平衡的与原来有什么不同指针向右偏
指针向右偏
.
如图是实验室制取气体的一些装置,据图回答有关问题.(友情提示:以下所选装置均填装置标号)
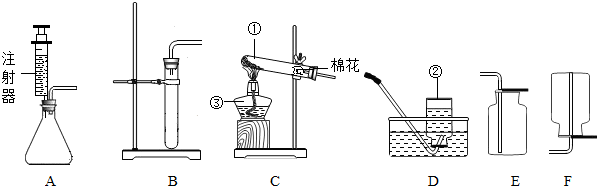
(1)写出序号为①②③的仪器名称:① ;② ;③ .
(2)写出你知道的化学实验中可选用装置C制取气体的文字表达式 ;
①该装置中试管口要略向下倾斜目的是 ;
②收集所得气体可选用的一种装置是 .
③如何检验收集的气体是氧气? .
(3)某学校化学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL集气瓶,分别装入25mL、50mL、75mL、100mL、125mL的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去;
③将带火星的木条依次插入1~5号瓶中,把观察到现象和计算数据,填入下表.
试回答下列问题:
①实验室中采用分解过氧化氢(H2O2)的方法制取氧气,可采用的发生装置是(填标号) ,理由是 .其反应的文字表达式是 ,该反应所属的基本反应类型是 .
②根据以上实验事实,下列说法中正确的是 (填写相应的标号).
A.只有在纯氧中才能使带火星的木条复燃
B.集气瓶中氧气的体积分数≥52.6%时,带火星的木条就能复燃
C.只要有氧气存在就可使带火星的木条复燃
③上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈.请你再举一例,将实验内容和实验现象填写在下表中:
(4)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂.你认为上图中最适合制取乙炔气体的发生装置是 ;如果用图所示装置收集乙炔,气体应从 (填“a”或“b”)端管口通入.
 查看习题详情和答案>>
查看习题详情和答案>>

(1)写出序号为①②③的仪器名称:①
(2)写出你知道的化学实验中可选用装置C制取气体的文字表达式
①该装置中试管口要略向下倾斜目的是
②收集所得气体可选用的一种装置是
③如何检验收集的气体是氧气?
(3)某学校化学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL集气瓶,分别装入25mL、50mL、75mL、100mL、125mL的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去;
③将带火星的木条依次插入1~5号瓶中,把观察到现象和计算数据,填入下表.
| 集气瓶标号 | 1 | 2 | 3 | 4 | 5 |
| 集气瓶中氧气的体积数 | 28.9% | 36.8% | 44.7% | 52.6% | 60.5% |
| 带火星木条的状况 | 微凉 | 亮 | 很亮 | 复燃 | 复燃 |
①实验室中采用分解过氧化氢(H2O2)的方法制取氧气,可采用的发生装置是(填标号)
②根据以上实验事实,下列说法中正确的是
A.只有在纯氧中才能使带火星的木条复燃
B.集气瓶中氧气的体积分数≥52.6%时,带火星的木条就能复燃
C.只要有氧气存在就可使带火星的木条复燃
③上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈.请你再举一例,将实验内容和实验现象填写在下表中:
| 实验内容 | 实验现象 | 实验结论 |
| 氧气浓度越大,燃烧越剧烈 | ||
 查看习题详情和答案>>
查看习题详情和答案>>