网址:http://m.1010jiajiao.com/timu_id_438674[举报]
第I卷(选择题,共48分)
一、选择题(共48分,每小题2 分,共24小题,每小题只有一个正确答案)
13 D 14 D
第II卷(非选择题,共52 分)
二、填空题(共23个空,每空2分,共46分)
25. CO2 NH3 CO2
26. ⑴ ②④ ;⑵ ①⑥; ⑶ ⑤
27.氧化剂 酸性 还原剂,酸性
28.不褪色 SO2 + Cl2 + 2H2O = 2HCl + H2SO4
29. H+ + HCO3― = H2O+ CO2↑
CO2 + 2OH― = H2O + CO32―
CO2 + CO32― + H2O = 2HCO3―
 30.(1) A:BaCl2 B:FeSO
30.(1) A:BaCl2 B:FeSO
(2) FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4, 4 Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(3)Al3+ + 3OH- = Al(OH)3↓, Al(OH)3 + OH- = AlO2- + 2H2O
三、计算题(写出必要的计算过程。6分)
31.解:设原NaNO3溶液的质量为x,则22%x=(100+x)14%,解得x=
所以,m(NaNO3) =
c(NaNO3) = n(NaNO3)/V(aq)
= 3.02mol/L …………………………………………… ……... 3分
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,水只作氧化剂的反应是
水只作还原剂的反应是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入足量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
| ||
| 高温高压 |
| ||
| 高温高压 |
②氯气与氢氧化钠溶液反应:
③铜片与稀硝酸的反应:
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是______(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是______(填编号)
水只作还原剂的反应是______(填编号)水既作氧化剂,又作还原剂是______(填编号)
水既不作氧化剂,又不作还原剂是______(填编号)
(3)根据你的理解,氧化还原反应的实质是______
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是______,还原剂是______.
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:______
②过量二氧化碳通入澄清石灰水:______
③往氯化铝溶液中加入足量的NaOH溶液:______
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:______
②氯气与氢氧化钠溶液反应:______
③铜片与稀硝酸的反应:______.
硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和______mL蒸馏水.配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器有______.
(2)图1中烧瓶中发生的离子反应方程式为______.
(3)图2是图1的改进装置,其优点有:①______;②______.
为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是______.晶体采用酒精淋洗的优点是______.
(5)方案2中物质甲可以是______(选填答案编号,下同),物质乙可以是______.
a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题______.
(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是______.
查看习题详情和答案>>
将一定量硝酸铜溶液、重铬酸铵溶液与氨水作用得沉淀物(CuNH4(OH)CrO4),过滤、洗涤,80℃烘干12h,最后焙烧得活性亚铬酸铜催化剂.用得到的催化剂按下列流程进行实验(已知:浓硫酸在常温下不氧化NO气体).
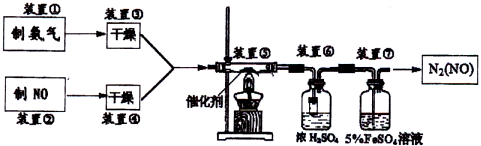
根据题意完成下列各题:
(1)装置③可以选的干燥剂为:
A.浓硫酸 B.碱石灰 C.硅胶 D.无水氯化钙
(2)若实验室只提供浓氨水和生石灰两种试剂,你会选择下图
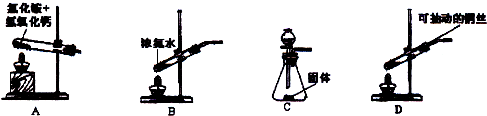
(3)若实验室提供稀硝酸、铜丝和小颗粒石灰石,若选用上图D装置制取较纯NO,其操作方法是:
(4)装置⑥中,小段玻璃管的作用是
(5)装置⑦的作用可能是:
(6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL N2,则NO的转化率为: