网址:http://m.1010jiajiao.com/timu_id_437346[举报]
一、(每题2分,共10分)w.w.w.k.s.5.u.c.o.m
1.D 2.B 3.C 4.D 5.A
二、(每题3分,共36分)
6.B 7.B 8.A 9.C 10.A 11.D 12.C 13.D 14.C 15.D 16.B 17.A
三、(每题4分,共20分)
18.B、D 19.B、C 20.A、C 21.A、D 22.B、C
四、(本题共24分)
23.(本题8分,每格1分)(1)1s22s22p3 第2周期ⅣA族
(2)
(3)两性
H++AlO2?+H2O.files/image034.gif) Al(OH)3
Al(OH)3.files/image034.gif) Al3++3OH?
Al3++3OH?
(4)非极性 CH4(g)+2O2(g) → CO2(g) +2H2O(l) +890.3kJ
24.(本题8分)
(1) 24e
.files/image035.gif) ↓ │
(配平2分,电子转移方向和数目各1分,共4分)
↓ │
(配平2分,电子转移方向和数目各1分,共4分)
12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl
(2)NH3(1分),NH4Cl 和HCl(各1分,共2分) (3)0.08(1分)
25.(本题8分,除指明外,每格1分)(1)0.05 mol/(L•min) (无单位不得分) >
(2)1 扩大容器体积(或减小压强) (3)= (4)放热 (2分) (5)20~40
五、(本题共24分)
26.(本题10分,除指明外,每格1分)
(1)CN-+ClO-→CNO-+Cl? ,2CNO-+6ClO?+8H+→N2↑+2CO2↑+3Cl2↑+4H2O
(2)浓硫酸, 除去Cl2 , 吸收CO2 , 防止空气中的CO2、水蒸气进入,干扰实验
(3)偏低,装置中残留有CO2未被完全吸收 (4)80%(2分)
27.(本题14分,除指明外,每格1分)
(1)反应速率突然减小(或铁片表面生成的气泡突然减少) e .files/image037.gif)
(2)洗涤、烘干(或干燥) 过滤
(3)b、d(各1分,共2分),加快铁片与硫酸的反应速率,Fe和Cu(1分,有缺不得分)
(4)抑制Fe2+、NH4+水解 (5)避免加热过程中晶体受热分解(或被氧化)
(6)b、d(各1分,共2分)
.files/image039.gif) 六、(本题共20分)
六、(本题共20分).files/image023.gif) w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(本题8分,除指明外,每格1分)(1)取代反应,加聚反应 (2) CH2== CH2
.files/image041.gif) (3)CH2== CH―CH2Cl + Br2 →
(3)CH2== CH―CH2Cl + Br2 →.files/image043.gif) (2分) (4)5 、
(2分) (4)5 、
29.(本题12分)(1)1,2―二溴乙烷(1分), .files/image045.gif) (1分)
(1分)
(2)取代反应(1分),NaOH醇溶液、加热(1分)
.files/image046.gif) (3)n
(3)n.files/image048.gif)
.files/image050.gif) (2分)
(2分)
.files/image051.gif) (4)
(4).files/image053.gif) +
+ .files/image045.gif)
.files/image055.gif) +
H2O(2分)
+
H2O(2分)
(5).files/image057.gif) (2分) (6)5(2分)
(2分) (6)5(2分)
七、(本题共16分).files/image023.gif) w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30. (1)1:3 (2分) (2)3.2(2分) (3)6048 (2分)
解:(1)Fe+2HCl→FeCl2+H2↑ n(H2)=.files/image059.gif) =0.005(mol) ∴ n(Fe)=0.005(mol)
=0.005(mol) ∴ n(Fe)=0.005(mol)
m(Fe) =0.005×56=0.28(g) ∴ m(FeS)=1.6?0.28=1.32(g) n(FeS) =.files/image061.gif) =0.015(mol)
=0.015(mol)
∴ n(Fe):n(FeS) = 0.005:0.015= 1:3
(2)300mL溶液种最多溶解H2S:n(H2S) =0.1×0.3=0.03(mol)
∴ n(FeS)= n(H2S)=0.03(mol) n(Fe)=0.01(mol)
∴ m(Fe)+m(FeS)= 0.01×56+0.03×88=3.2(g)
(3)当a=
若全部反应需盐酸:2×(0.3+0.1) =0.8 (mol) > 2×0.3=0.6(mol)
∴ 盐酸不足,以盐酸的量为计算标准
∴ 产生的H2、H2S共为:n(气体)=.files/image063.gif) n(HCl) =
n(HCl) =.files/image063.gif) ×0.6=0.3(mol),
×0.6=0.3(mol),
其中0.03mol的H2S溶解于溶液
∴ 收集到的气体为:0.3?0.03=0.27 (mol)
V(气体)=0.27×22.4=6.048(L)=6048mL
31.(1)c、d (2分) (2)①2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2(1分)
②.files/image065.gif) ≥
≥.files/image067.gif) (或
(或.files/image069.gif) (2分)③1:5 (3分)
(2分)③1:5 (3分)
解:(2)②将20%的N2O4看作成2份NO2,即NO2共有
若气体恰好被吸收则:.files/image065.gif) ≥
≥.files/image067.gif)
生成的产物NaNO2、NaNO3中钠原子与氮原子均为1:1,所以由原子守恒得:
n(Na2CO3)=.files/image063.gif) n(Na)=
n(Na)=.files/image063.gif) n(N)=
n(N)=.files/image063.gif) [n(NO2)+n(NO)]=
[n(NO2)+n(NO)]=.files/image063.gif) ×
×.files/image071.gif) =
=.files/image073.gif) (mol)
(mol)
∴ c(Na2CO3)= .files/image073.gif) ÷0.2=
÷0.2=.files/image076.gif) (mol/L)
(mol/L)
③设:
.files/image077.gif) x+y+z=
x+y+z=.files/image079.gif) =0.09
解得: x=0.01(mol)
=0.09
解得: x=0.01(mol)
2x+y+3z=.files/image081.gif) ×4 (得失电子守恒)
y=0.05(mol)
×4 (得失电子守恒)
y=0.05(mol)
.files/image077.gif) 2x+y+z=0.05×2 (氮原子、钠原子守恒) z=0.03(mol)
2x+y+z=0.05×2 (氮原子、钠原子守恒) z=0.03(mol)
∴ V(N2O4):V(NO2) = n(N2O4):n(NO2) =x:y= 1:5
(15分)[物质结构与性质] 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍。X原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为_______________。
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为_____________,根据价层电子对互斥理论预测BA2D的分子构型为____________。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)________
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体
结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
根据表格中的数据:判断KCl、MgO、TiN三种离子晶体熔点从高到低的顺序是______________。MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有__________________个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__________________。
查看习题详情和答案>>
(15分)[物质结构与性质] 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍。X原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为_______________。
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为_____________,根据价层电子对互斥理论预测BA2D的分子构型为____________。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)________
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体
结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__________________。 查看习题详情和答案>>
丁子香酚结构简式为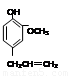 ,有机物F是丁子香酚的一种同分异构体,是有机化工原
,有机物F是丁子香酚的一种同分异构体,是有机化工原
料,用于合成药物的中间体。
某校兴趣小组设计以下方案合成F:
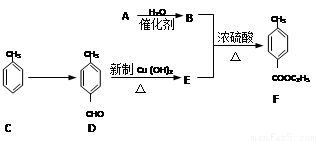
试回答下列问题:
(1)下列物质不能与丁子香酚反应的是 (填字母)。
A.NaOH B.NaHCO3 C.Br2 D.C2H5OH
(2)关于A→B的反应类型可能是 (填字母)。
A.加成反应 B.取代反应 C.聚合反应 D.消除反应
(3)写出D→E反应的化学方程式 。
(4)满足下列条件的E的同分异构体有 种。
①含有苯环,且苯环上只有两个取代基
②能发生银镜反应
③能与氢氧化钠反应
(5)由C经过一步反应可制得一种烈性炸药,写出该反应的化学方程式: 。
查看习题详情和答案>>
(15分)[物质结构与性质] 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍。X原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为_______________。
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为_____________,根据价层电子对互斥理论预测BA2D的分子构型为____________。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)________
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体
结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:

|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是______________。MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有__________________个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__________________。
查看习题详情和答案>>
 ,有机物F是丁子香酚的一种同分异构体,是有机化工原
,有机物F是丁子香酚的一种同分异构体,是有机化工原