网址:http://m.1010jiajiao.com/timu_id_433326[举报]
 13.A 14.B 15. BC 16.C 17.C 18.AD
13.A 14.B 15. BC 16.C 17.C 18.AD
选做29.(1)4(2)1
19.(1)A(4分);(2)如图(4分);
(3)半导体(3分);
(4)4.0V(2分)、0.40Ω(2分);
(5)1.990(3分)
20(16分)设“卡西尼”号的质量为m,土星的质量为M. “卡西尼”号围绕土星的中心做匀速圆周运动,其向心力由万有引力提供.
, (4分)
其中T = , (2分) 所以:M = . (3分)
设土星表面处有一质量为m1的物体,则有
, (4分) 得:g = (3分)
21.(18分)解:摩托车 S1=at12/2+vmt2 …… ①
vm=at1=20 …… ② 卡车 S2=voT=10T …… ③
S1=S2+100 …… ④ T=t1+t2 …… ⑤
T≤120s a≥
22.(20分)解:小球到达板上端时竖直分速度  2分
2分
设小球此时速度方向与竖直方向之间的夹角为θ ,  2分
2分
在电场中小球所受合外力方向与运到方向相同,设板间距离为d
tanθ = = 2分 L= 2分
解得: 2分 (2)进入电场前
2分 (2)进入电场前
 4分
4分
电场中运动过程  4分 解得:
4分 解得: 2分
2分
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。

(3)X晶体中包含的化学键类型为______。(填字母标号)
| A.离子键 | B.共价键 | C.配位键 | D.金属键 |
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
A.《物质结构与性质》
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;基态Ni原子的电子排布式为__________。
(2)配合物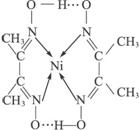 分子内的作用力有____________(填编号)。
分子内的作用力有____________(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如下图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为____________。

B.《实验化学》
乙醛与银氨溶液的反应常因条件控制不当,会出现黑色浊液、长时间没有银析出、析出的银镜不均匀或发暗等现象,影响了银镜反应的效果。
某研究小组为探究乙醛发生银镜反应的最佳实验条件,进行了有关实验,相关数据如下表:
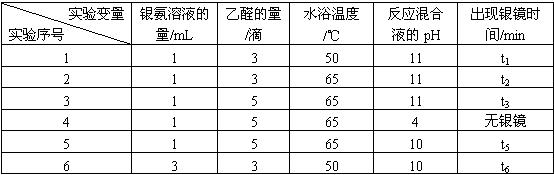 请回答下列问题:
请回答下列问题:
(1)写出乙醛与银氨溶液发生银镜反应的化学方程式:_______________________________。
(2)若只进行实验1和实验2,其探究的目的是_____________。
(3)实验__________(填序号)组合,可探究混合液pH对银镜反应的影响。
(4)实验4无银镜出现的原因是_____________________________________________。
(5)试管内壁的银镜用硝酸洗涤,可以回收硝酸银溶液。你认为选用____________(填“浓硝酸”或“稀硝酸”)较好,理由是___________________________________________________。
查看习题详情和答案>>
(1)已知:![]() ,D为非金属单质。
,D为非金属单质。
①若A为非金属单质,则C可能为_____________。
②若A为某无机气态化合物,则C可能为_____________。
(2)已知:![]()
①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法____________________________________________________________________。
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是(按顺序写出合理的一个物质的化学式即可)
A_____________,B_____________,C_____________,D_____________。
查看习题详情和答案>>(1)已知:![]() ,D为非金属单质。
,D为非金属单质。
①若A为非金属单质,则C可能为______________。
②若A为某无机气态化合物,则C可能为______________。
(2)已知: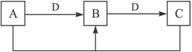
①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法。
______________________________________________________________________
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是(按顺序写出合理的一个物质的化学式即可)
A______________,B______________,C______________,D______________。
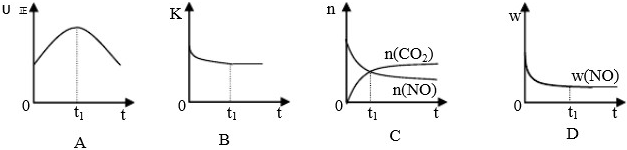
查看习题详情和答案>>(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
若该反应在绝热、恒容的密闭体系中进行,下列示意图甲正确且能说明反应在进行到t1时刻达到平衡状态的是
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol
H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
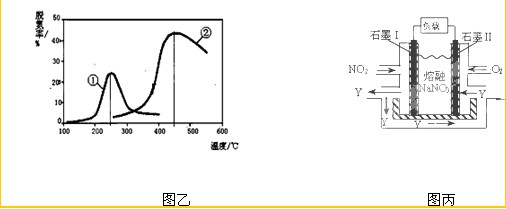
(3)用NH3催化还原NOX也可以消除氮氧化物的污染.图乙,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
①该反应的△S
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=
③以下说法正确的是
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图丙.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去.反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为