摘要:(1)物理性质:无色液体.沸点38.4℃比水重.不溶于水.(2)化学性质:
网址:http://m.1010jiajiao.com/timu_id_428085[举报]
溴乙烷的结构和物理性质
溴乙烷的分子式为_____________,结构简式为_____________。它是_____________色液体,沸点38.4 ℃,密度比水_____________,_____________溶于水,溶于多种_____________溶剂。
查看习题详情和答案>> SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为:
SnO2+2C
Sn+2CO
| ||
SnO2+2C
Sn+2CO
,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
| ||
Sn2++2e-=Sn
Sn2++2e-=Sn
.第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,右图是制取SnCl4的实验装置.
试回答以下问题:
(1)装置A中反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)当反应生成SnCl4时,应熄灭
B
B
处的酒精灯,理由是依靠反应放出的热量维持Sn的熔化
依靠反应放出的热量维持Sn的熔化
;(3)装置B的主要缺点是
缺少温度计
缺少温度计
,装置D的主要缺点是装置D后应连接一个装有碱石灰的干燥管
装置D后应连接一个装有碱石灰的干燥管
;(4)即使装置B和装置D进行改进后,老师说该实验装置设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称)并在下边方框中画出.

(1)某研究性学习小组利用所学知识进行下列实验研究.如图I所示(导管出口高于液而)请回答下列问题:?
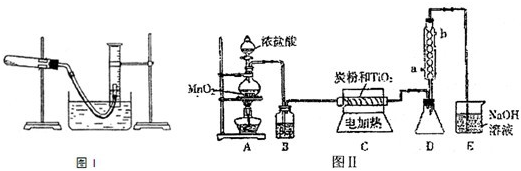
①测量收集到气体的体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积.这三步操作的正确顺序是:
②测量收集到气体体积时,如何使量筒内外液面的高度相同?
(2)在图I中利用高锰酸钾分解制氧气,为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰.“过滤”装置中使用的玻璃仪器除烧杯外还有
(3)图II是实验室制取TiCl4的装置.四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中的水蒸汽即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl).在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体.
①A装置中反应的离子方程式
②B装置中的试剂及其作用是
③D装置中冷凝水的方向为
④请指出此装置的缺陷和不妥之处?
查看习题详情和答案>>

①测量收集到气体的体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积.这三步操作的正确顺序是:
bac
bac
(请填写步骤代号).②测量收集到气体体积时,如何使量筒内外液面的高度相同?
慢慢将量筒下移
慢慢将量筒下移
.(2)在图I中利用高锰酸钾分解制氧气,为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰.“过滤”装置中使用的玻璃仪器除烧杯外还有
普通漏斗
普通漏斗
.?(3)图II是实验室制取TiCl4的装置.四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中的水蒸汽即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl).在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体.
①A装置中反应的离子方程式
MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O
| ||
②B装置中的试剂及其作用是
浓硫酸
浓硫酸
,干燥氯气
干燥氯气
?③D装置中冷凝水的方向为
a
a
进b
b
出(填字母)?④请指出此装置的缺陷和不妥之处?
| 编号 | 装置的缺陷和不妥之处 |
| a | TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置 TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置 |
| b | TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置 TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置 |
| … | 由于CO气体有毒,缺少CO的处理装置 由于CO气体有毒,缺少CO的处理装置 |
某学生用图示装置制取溴苯和溴乙烷.已知C2H5OH+HBr 一定条件 C2H5Br+H2O.溴乙烷为无色液体,难溶于水,沸点38.4℃、熔点-119℃,密度为1.46g.cm-3.主要实验步骤如下:①向烧瓶中加入一定量苯和液溴;②向锥形瓶中加入乙醇至恰好没于进气导管口;③将A装置中纯铁丝小心向下插入液体中;④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10min.

请填写下列空白:
(1)步骤①之前还应进行的一项操作是
(2)装置A中纯铁丝的作用是
(3)C装置中U型管内用蒸馏水封住管底的作用是
(4)反应完毕后,U型管内的现象是
(5)步骤④中可否用大火加热
查看习题详情和答案>>

请填写下列空白:
(1)步骤①之前还应进行的一项操作是
检查气密性
检查气密性
(2)装置A中纯铁丝的作用是
催化作用
催化作用
,导管a的作用是导气、冷凝回流
导气、冷凝回流
(3)C装置中U型管内用蒸馏水封住管底的作用是
溶解吸收HBr,防止HBr及产物逸出
溶解吸收HBr,防止HBr及产物逸出
(4)反应完毕后,U型管内的现象是
液体分层,上层为水层,下层为无色油状液体
液体分层,上层为水层,下层为无色油状液体
;分离出溴乙烷时所用主要仪器名称是(只填一种)分液漏斗
分液漏斗
(5)步骤④中可否用大火加热
不能
不能
,理由是易发生副反应生成乙醚、乙烯等
易发生副反应生成乙醚、乙烯等
.SnCl4的制备需分两步进行:第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为
已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,如图1是制取SnCl4的实验装置.

试回答以下问题:
(1)本试验中检查制气装置A气密性的方法是
装置A中反应的化学方程式为
(2)装置B、C中的药品名称分别是
(3)当反应生成SnCl4时,应熄灭
(4)老师说该实验装置E设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称,装置图尽可能简单)并在图2的方框中画出.
(5)实验制得的SnCl4中因溶解了Cl2而略显黄色.提纯SnCl4的方法是
查看习题详情和答案>>
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为
SnO2+2C
Sn+2CO
| ||
SnO2+2C
Sn+2CO
.
| ||
已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
Sn2++2eˉ=Sn
Sn2++2eˉ=Sn
.第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,如图1是制取SnCl4的实验装置.

试回答以下问题:
(1)本试验中检查制气装置A气密性的方法是
将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱
将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱
.装置A中反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)装置B、C中的药品名称分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(3)当反应生成SnCl4时,应熄灭
D
D
处的酒精灯,理由是依靠反应放出的热量维持SnCl4的生成
依靠反应放出的热量维持SnCl4的生成
.(4)老师说该实验装置E设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称,装置图尽可能简单)并在图2的方框中画出.
(5)实验制得的SnCl4中因溶解了Cl2而略显黄色.提纯SnCl4的方法是
蒸馏
蒸馏
.