摘要:2Na + O2Na2O24Na+O2=2Na2O②与水反应2Na+2H2O=2NaOH+H2↑现象及解释:浮在水面上――密度比水小,熔化成小球――钠的熔点低.反应放热,四处游动――生成气体,酚酞变红――生成碱.③与酸反应2Na+2H+=2Na++H2↑ 钠不足.直接与酸反应,钠过量.先与酸反应再与水反应.④与盐溶液反应钠与盐溶液反应.先考虑Na与水反应生成NaOH.再考虑NaOH是否与盐反应.a.投入NaCl溶液中.只有H2放出.2Na+2H2O=2NaOH+H2↑b.投入饱和NaCl溶液中.有H2放出.还有NaCl晶体析出.c.投入NH4Cl溶液中.有H2和NH3逸出.2Na+2NHCl=2NaCl+2NH3↑+H2↑d.投入CuSO4溶液中.有气体放出和蓝色沉淀生成.2Na+H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑(3)钠的保存及用途: ①保存:钠的化学性质非常活泼.易与空气中的O2.H2O等反应.保存在煤油中.②用途:a.工业上用于冶炼金属:4Na+TiCl4=Ti+4NaCl b.Na―K合金用作原子反应堆的导热剂c.制造高压钠灯.作为电光源.
网址:http://m.1010jiajiao.com/timu_id_428031[举报]
四种短周期元素的性质或结构信息如表所示,请根据信息回答下列问题:
(1)B在元素周期表中的位置是第
 .
.
(2)写出C单质与水反应的化学方程式:
(3)D的最高价氧化物晶体的硬度
(4)A、B两元素非金属性较强的是(写元素符号)
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质或结构信息 | 室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧发出明亮的蓝紫色火焰 | 单质在常温、常压下是气体,能溶于水;原子的M层比L层少1个电子 | 单质为质软、银白色固体,导电性强;单质在空气中燃烧发出黄色火焰 | 原子的最外电子层上电子数比内层电子总数少6;单质为空间网状晶体,具有很高的熔沸点 |
三
三
周期ⅦA
ⅦA
族,写出A原子的原子结构示意图:

(2)写出C单质与水反应的化学方程式:
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.A与C形成的化合物溶于水后,溶液的pH大于
大于
7(填“大于”、“等于”或“小于”).(3)D的最高价氧化物晶体的硬度
大
大
(填“大”或“小”),其理由是二氧化硅属于原子晶体
二氧化硅属于原子晶体
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
;写出能证明这一结论的实验事实:高氯酸的酸性比硫酸酸性强
高氯酸的酸性比硫酸酸性强
.化学必修一教材47页3-2实验演示的是钠与氧气的反应,实验操作及现象如下
(1)从
(2)把一小块金属钠放在
(3)该实验所涉及的方程式为:
(4)而3-3实验演示的是钠与水的反应,反应的离子方程式为:
查看习题详情和答案>>
(1)从
煤油
煤油
中用镊子
镊子
取一小块钠,用小刀切开.(2)把一小块金属钠放在
坩埚
坩埚
里,加热时,钠先熔化为银白色的小球,然后燃烧.火焰呈黄
黄
色.最后生成淡黄
淡黄
色固体.(3)该实验所涉及的方程式为:
2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
| ||
(4)而3-3实验演示的是钠与水的反应,反应的离子方程式为:
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
;往反应后的溶液中投入一小块铝片,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2012?房山区二模)已知由短周期元素组成的物质 A、B、C、D,具有如下反应关系:

(1)通常若A为黄绿色单质,B为无色液态化合物,且0.1mol/L的C溶液pH=1,则D的化学式是
(2)若B为化合物,且A、C两种无色气体相遇变为红棕色,则B的电子式是
 .
.
(3)若A为单质,C、D为常见易燃气体,则A与B反应的化学方程式是
(4)若A为单质,B通常是无色液态化合物,灼烧D产生黄色火焰,则:
①如B分子含有10个电子,A与B反应的离子方程式是
②如B分子含有18个电子,如下图所示,可将其组成B-O2燃料电池.
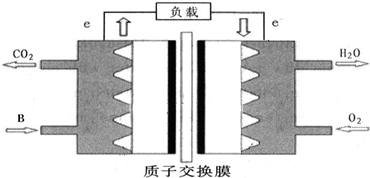
其正极反应
③如B分子含有32个电子,B的电离方程式是 CH3COOH?CH3COO-+H+.
查看习题详情和答案>>

(1)通常若A为黄绿色单质,B为无色液态化合物,且0.1mol/L的C溶液pH=1,则D的化学式是
HClO
HClO
.(2)若B为化合物,且A、C两种无色气体相遇变为红棕色,则B的电子式是


(3)若A为单质,C、D为常见易燃气体,则A与B反应的化学方程式是
C+H2O
CO↑+H2↑
| ||
C+H2O
CO↑+H2↑
.
| ||
(4)若A为单质,B通常是无色液态化合物,灼烧D产生黄色火焰,则:
①如B分子含有10个电子,A与B反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.②如B分子含有18个电子,如下图所示,可将其组成B-O2燃料电池.

其正极反应
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
;负极反应2CH3OH+2H2O-12e-=2CO2↑+12H+
2CH3OH+2H2O-12e-=2CO2↑+12H+
.③如B分子含有32个电子,B的电离方程式是 CH3COOH?CH3COO-+H+.
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素符号:A
(2)写出C2D 的电子式为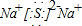
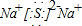 .
.
(3)写出C单质在加热条件下与B单质充分反应的化学方程式
查看习题详情和答案>>
(1)元素符号:A
C
C
BO
O
CNa
Na
DS
S
.(2)写出C2D 的电子式为
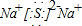
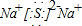
(3)写出C单质在加热条件下与B单质充分反应的化学方程式
2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.
| ||
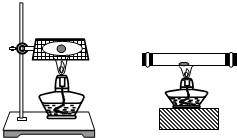 钠在空气中燃烧(右左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质.
钠在空气中燃烧(右左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质.(1)请假设黑色固体物质可能产生的原因是:
假设①
金属钠上没有擦干净的煤油不完全燃烧后生成碳
金属钠上没有擦干净的煤油不完全燃烧后生成碳
;假设②
酒精不完全燃烧生成的碳
酒精不完全燃烧生成的碳
;假设③
酒精燃烧产生的二氧化碳与金属钠反应生成的碳
酒精燃烧产生的二氧化碳与金属钠反应生成的碳
.(2)为确认以上其中一种假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,
因此黑色碳可能是二氧化碳与金属钠发生置换反应而生成.该同学设计实验如下:
甲打孔器钻取一段金属钠,取中间一小块钠放在充满二氧化碳气体的试管(上右图)中加热,观察到钠燃烧发出黄色火焰,并有黄色固体和黑色固体生成,生成的黄色固体立即变成白色.请回答下列问题:
①用打孔器这种方法取金属钠的原因是
保证所取的是纯净的钠
保证所取的是纯净的钠
;②产生以上现象的可能的化学反应方程式为:
2Na+CO2
C+Na2O2;2Na2O2+2CO2
2Na2CO3+O2;或Na2O2+2Na
2Na2O
| ||
| ||
| ||
2Na+CO2
C+Na2O2;2Na2O2+2CO2
2Na2CO3+O2;或Na2O2+2Na
2Na2O
.
| ||
| ||
| ||