网址:http://m.1010jiajiao.com/timu_id_428027[举报]
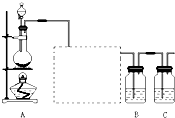
(1)装置A的分液漏斗中盛装的试剂是
| ||
| ||
(2)画出虚线框内的实验装置图,所加试剂为
(3)装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子.可说明氯比硫非金属性强的是
A.全部 B.②③④⑥⑦C.①②④⑤⑥D.除 ①以外
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
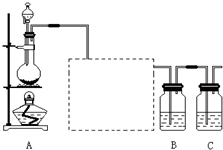
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置A的分液漏斗中盛装的试剂是
(2)画出虚线框内的实验装置图,并注明所加试剂,

(3)装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
已知非金属单质硫(S)是黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是__________ ,烧瓶中的化学反应方程式__________ 。
(2)画出虚线框内的实验装置图,并标明所需试剂,该装置的作用是除去其中的酸性气体。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为__________ ,
该反应的离子方程式是__________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是__________
A.全部 B.②③④⑥⑦ C.②④⑤⑥⑦ D.除 ①以外
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式 __________
查看习题详情和答案>>(1)铝原子核外电子云有
(2)镓(Ga)与铝同族.写出镓的氯化物和氨水反应的化学方程式
(3)硅与铝同周期.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O?CaO?6SiO2.盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法.如:2Al+4BaO
| 高温 |
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO?Al2O3比Al2O3稳定 d.Ba的沸点比Al的低.
[化学――物质结构与性质](13分)
![]() Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
![]() ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素;
![]() ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn
![]() ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数;
![]() ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)Z2+ 的核外电子排布式是 。
(1)Z2+ 的核外电子排布式是 。
![]() (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
![]() (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
![]() a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
![]() c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
![]() (4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
![]() (5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
![]() (6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
![]()