网址:http://m.1010jiajiao.com/timu_id_427998[举报]
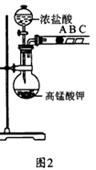
学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究;乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。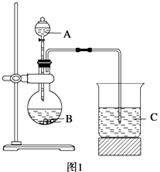
(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。
学习了元素周期律的有关知识后,同学们设计了多个实验在实验室探究同周期及同主族元素性质的递变规律。甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究;乙组同学设计了如图2装置来验证卤素单质氧化性的相对强弱的实验。

(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
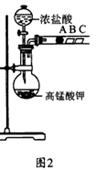
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。
查看习题详情和答案>>


(1) 甲组同学设计实验的依据是 ;写出选用物质的名称:A 、B 、C ;烧杯C中发生反应的离子方程式 ,通过实验得出的结论:元素非金属性强弱顺序为 。
(2) 乙组同学实验过程如下:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ………
①验证氯气的氧化性强于碘的实验现象是 。
②B中溶液发生反应的离子方程式是 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
。
④过程Ⅲ实验的目的是 。
⑤氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 能力逐渐减弱。