网址:http://m.1010jiajiao.com/timu_id_427997[举报]
(16分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数。 |
| Y | 原子核外的L层有3个未成对电子。 |
| Z | 在元素周期表的各元素中电负性仅小于氟。 |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2) X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的核外电子排布式为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)x Q 2]+,则中心原子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6) Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
查看习题详情和答案>>
 表。
表。| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数。 |
| Y | 原子核外的L层有3个未成对电子。 |
| Z | 在元素周期表的各元素中电负性仅小于氟。 |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外
 共有 种不同运动状态的电子,有 种不同能级的电子。
共有 种不同运动状态的电子,有 种不同能级的电子。(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化
 物中,沸点由高到低
物中,沸点由高到低 的排列次序依次为(写化学式) 。
的排列次序依次为(写化学式) 。(4)R的最高化合价为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]C
 l3 B.[R(H2O)5Cl]Cl2·H2O
l3 B.[R(H2O)5Cl]Cl2·H2OC.
 [R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不
 污染环境,其反应的化学方程式为 。
污染环境,其反应的化学方程式为 。(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(2)氯氨(NH2Cl)可作杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:___________________。
(3)氯溴海因(C5H6BrClN2O2)是一种比较安全的氯气和氯制剂的替代产品,其结构简式如图所示。氯溴海因在水中的水解过程比较复杂,主要生成次卤酸和海因,请写出海因的结构简式:____________。

A.MnO2 B.KMnO4溶液 C.稀盐酸 D.NaHCO3溶液
(5)消毒剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为: HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时,转移的电子数是______。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(12分)
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:

(1)下列由极性键形成的非极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.电负性:N<O<F
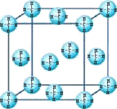
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的 。

A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体[来源:学*科*网]
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为: 。
查看习题详情和答案>>