摘要:5.等效平衡在条件不变时.可逆反应不论采取何种途径.即由正反应开始或由逆反应开始.最后所处的平衡状态是相同,一次投料或分步投料.最后所处平衡状态是相同的.某一可逆反应的平衡状态只与反应条件(物质的量浓度.温度.压强或体积)有关.而与反应途径无关.(1)等温等容条件下等效平衡.对于某一可逆反应.在一定T.V条件下.只要反应物和生成物的量相当(即根据系数比换算成生成物或换算成反应物时与原起始量相同).则无论从反应物开始.还是从生成物开始.二者平衡等效.(2)等温.等压条件下的等效平衡.反应前后分子数不变或有改变同一可逆反应.由极端假设法确定出两初始状态的物质的量比相同.则达到平衡后两平衡等效.(3)在定温.定容情况下.对于反应前后气体分子数不变的可逆反应.只要反应物的物质的量的比值与原平衡相同.两平衡等效.
网址:http://m.1010jiajiao.com/timu_id_427961[举报]
| 运用化学反应原理可以更好的分析化学反应的本质 。 (1)下列四组物质反应,其中与其它三组有本质不同的是_______。 A.Na2O2 + H2O B.F2 + H2O C.Cl2 + H2O D.NO2 + H2O (2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成_______沉淀 ( 填化学式 );当两种沉淀共存时溶液中 (3) 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)  N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: | ||||||||
 | ||||||||
① 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) ②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1_____K2;若反应进行到状态D 时,V正___V逆(填“>”、“<”或“=”) ③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是 | ||||||||
 | ||||||||
| (4)分析下表提供的数据: | ||||||||
| ||||||||
| ① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式:____________; __________________。 ②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序:_________________。 |
运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”) 184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于 kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g) 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①该反应的 0(填“>’或“<”)。
0(填“>’或“<”)。
②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液) 。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式 。
Na2CO3水溶液呈碱性,其原因是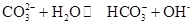 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”) 184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于 kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)
 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①该反应的
 0(填“>’或“<”)。
0(填“>’或“<”)。②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液) 。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式 。
Na2CO3水溶液呈碱性,其原因是
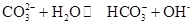 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化: 2SO2+O2 2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是(
)
2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是(
)
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%地转化为SO3
C.达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态
D.达到平衡时,SO2的浓度与SO3的浓度相等
查看习题详情和答案>>
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化: 2SO2+O2 2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
|
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2 | |
| [ ] | |
A. |
使用催化剂是为了加快反应速率,提高生产效率 |
B. |
在上述条件下,SO2不可能100%地转化为SO3 |
C. |
达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态 |
D. |
达到平衡时,SO2的浓度与SO3的浓度相等 |