摘要:1.分散系化学上把一种或几种物质分散成很小的微粒分布在另一种物质中所组成的体系.分散成粒子的物质叫分散质.另一种物质叫分散剂.分散质.分散剂均可以是气态.液态或固态.
网址:http://m.1010jiajiao.com/timu_id_427946[举报]
(1)氨易溶于水的原因是 ; .(写出两点即可)
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越 (填“强”或“弱”).以下各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为 .
(3)熔点、沸点HF HI(填“>”或“<”);原因: .
(4)下列4种物质熔点沸点由高到低排列为 (填序号)
①金刚石(C-C) ②锗(Ge-Ge) ③晶体硅(Si-Si) ④金刚砂(Si-C)
(5)为了减缓温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有 mol σ键和 mol π键断裂.
查看习题详情和答案>>
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
(3)熔点、沸点HF
(4)下列4种物质熔点沸点由高到低排列为
①金刚石(C-C) ②锗(Ge-Ge) ③晶体硅(Si-Si) ④金刚砂(Si-C)
(5)为了减缓温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有
(1)s电子的原子轨道呈
(2)某元素的原子序数是29,则元素符号是
(3)共价键的类型有两种分别是σ键和π键,σ键的对称方式为
(4)某元素位于元素周期表中第四周期,第VA族,元素符号是
(5)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
查看习题详情和答案>>
球
球
形,p电子的原子轨道呈纺锤
纺锤
形;(2)某元素的原子序数是29,则元素符号是
Cu
Cu
,价电子排布式是3d104s1
3d104s1
;(3)共价键的类型有两种分别是σ键和π键,σ键的对称方式为
轴对称
轴对称
,π键的对称方式为镜面对称
镜面对称
;(4)某元素位于元素周期表中第四周期,第VA族,元素符号是
As
As
,最高价氧化物对应的水化物的化学式H3AsO4
H3AsO4
;(5)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
强
强
.下表为长式周期表的一部分,其中的序号代表对应的元素。

(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
杂化, 键与
键与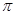 键的个数比为
。
键的个数比为
。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为 。其中⑥元素核外电子的电子排布图为 。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为 ;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为 。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型 ,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为 ,形成的化学键为 。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序) 。
查看习题详情和答案>>