网址:http://m.1010jiajiao.com/timu_id_427814[举报]
甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。 w_w w. k#s5_u.c o*m
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳: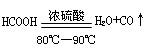 ,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
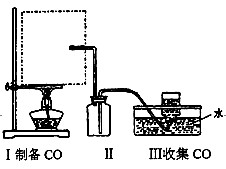
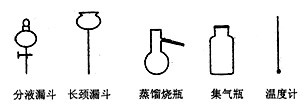
①从下图挑选所需的容器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、
胶皮管,固定装置不用画)w_w*w.k*s 5*u.c*o m
②装置Ⅱ的作用是______________________________________________。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4NaHCO3==Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+5H2O==2Cu(HCOO)2·4H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
③步骤i是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是__________________________________________。w_w*w.k*s 5*u.c*o m
④步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70~80℃,如果看到_____________________(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是_______________________________。
⑥用乙醇洗涤晶体的目的是________________________________。
查看习题详情和答案>>某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验] 制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。W$w#w.k-s+5=u.c.o*m
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3— 能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO![]() 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② …… | 若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO![]() 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论_ __ __,并简述理由: (用离子方程式表示)。
查看习题详情和答案>>下列说法中正确的是w.w.w.k.s.5 u.c.o.
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
查看习题详情和答案>>