网址:http://m.1010jiajiao.com/timu_id_426450[举报]
1.C 2.B 3.B 4.D 5.A 6.C 7.A 8.C 9.A 10.B 11.D 12.A 13.C 14.D 15.B 16.B 17.BD 18.AB 19.A 20.B 21.C
22. (1)104.05 0.520 200(6分)
 (2)
(2)
①ABEF(4分)
②如图所示(4分)
③随着导体中的电流增大,温度升高,电阻率增大,电阻增大(4分)
23.(14分) 解:对受试者,由起点终点线向折返线运动的过程中
加速阶段有: s ①
s ①  ②
②
减速阶段有: s ③
s ③  ④
④
匀速阶段有: s ⑤
s ⑤
由折返线向起点终点线运动的过程中
加速阶段有: s ⑥
s ⑥  ⑦
⑦
匀速阶段有: s ⑧
s ⑧
由①③⑤⑥⑧得
受试者10米折返跑的成绩为: s ⑨
s ⑨
评分标准:①③⑤⑥⑧每式2分,②④⑦⑨每式1分,共14分。
24. (18分)(1)小车与墙壁碰撞后向左运动,木块与小车间发生相对运动将弹簧压缩至最短时,二者速度相等,此时弹簧的弹性势能最大,此过程中,二者组成的系统动量守恒,设弹簧压缩至最短时,小车和木块的速度大小为v,根据动量守恒定律有
m1v1-m2v0=(m1+m2)v ①
解得 v=
设最大的弹性势能为EP,根据机械能守恒定律可得
EP= m1v12+
m1v12+ m2v02-
m2v02- (m1+m2)v2
③
(m1+m2)v2
③
由②③得EP=3.6J ④
(2)根据题意,木块被弹簧弹出后滑到A点左侧某处与小车具有相同的速度v’ 时,木块将不会从小车上滑落, 此过程中,二者组成的系统动量守恒,故有v’ =v==
木块在A点右侧运动过程中,系统的机械能守恒,而在A点左侧相对滑动过程中将克服摩擦阻力做功,设此过程中滑行的最大相对位移为L,根据功能关系有
μm2gL=
 m1v12+
m1v12+ m2v02-
m2v02- (m1+m2)v’2
⑥
(m1+m2)v’2
⑥
解得L=
即车面A点左侧粗糙部分的长度应大于
评分标准:③⑥每式4分,①②④⑤⑦每式2分,共18分。
25.(22分) 解:(1)同时存在电场和磁场时粒子做直线运动  ①
①
只有磁场时,粒子做圆周运动  ②
②
只有电场时,粒子做类平抛  ③
③

 ④
④  ⑤
⑤
由①②③④⑤解得 ⑥
⑥
则粒子速度大小  ⑦
⑦
速度方向与x轴夹角  ⑧
⑧
粒子与x轴的距离  ⑨
⑨
(2)撤电场加上磁场后 
解得  ⑩
⑩
粒子运动轨迹如图所示,圆心C位于与速度v方向垂直的直线上,该直线与x轴和y轴的夹角均为π/4,有几何关系得C点坐标为  ⑾
⑾  ⑿
⑿
过C作x轴的垂线,在ΔCDM中  ⒀
⒀
 ⒁
⒁
解得  ⒂
⒂
M点横坐标  (16)
(16)
评分标准:①②⑥⑨⑩(16)每式2分,③④⑤⑦⑧⑾⑿⒀⒁⒂每式1分,共22分。
26.(10分)
(2)1:4 (2分)
(3)酸性 氧化性 (2分)
(4)0.8mol (2分)
27.(18分,每空2分)
(1) ,非极性,
,非极性, 
28.(16分)
(一)A D
(2分)
 既能溶于硫酸溶液,又能溶于
既能溶于硫酸溶液,又能溶于 溶液 (1分)
溶液 (1分)
(二)  (2分)
(2分)  (3分)
(3分)
在高于
在溶液中+2价Cu比+1价Cu稳定 (1分)
(三)(1)方案1不合理(1分),因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液(1分)
方案2合理(1分),因为氧化亚铜与稀硫酸生成Cu和 ,导致溶液呈蓝色 (1分)
,导致溶液呈蓝色 (1分)
(2分)

30、(每空2分,共20分)(1)细胞质基质 线粒体
(2)谷丙转氨酶(GPT) 蛋白质、磷脂
(3)舒张
(4)特异性 效应T细胞
(5)不能,此时细胞不处于细胞的分裂期
(6)纤维素 肝糖元
31、(22分)
Ⅰ、(12分)
(1)BByy bbYY (2分)
(2)(共5分)
解:P BByy × bbYY
(黑颖) ↓ (黄颖) (1分)
F1 BbYy(黑颖)
↓ (1分)
F2 9B Y 3 B yy 3bbY 1bbyy (1分)
(黑颖)+(黑颖) (黄颖) (白颖) (1分)
12 : 3 : 1 (1分)
(3)黑颖:黄颖:白颖=2:1:1(1分)
(4)②花药离体培养 秋水仙素处理(2分)
③BBYY、BByy (1分)
④有黄颖植株出现(1分)
Ⅱ、(10分)(答案合理即可给分)
(1)隐 X 1/8 (3分)
(2)将该只雌果蝇与种群中任一雄果蝇交配,统计子代雌、雄果蝇的数目。若子代雌、雄果蝇比例为1:1,说明该雌果蝇为纯合子;若子代雌、雄果蝇比例为2:1,说明该雌果蝇为杂合子(2分,)
(3)①将变异的残翅雄果蝇与长翅雌蝇交配,如果后代有残翅出现,则残翅为显性;如果后代全为长翅,无残翅出现,则残翅为隐性(2分)
② 雌雄均为长翅 全为长翅 出现雄性残翅(3分)
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:
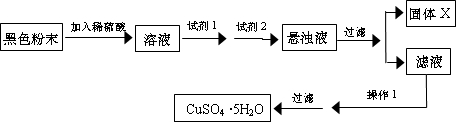
试回答:
①试剂I为
②固体X的化学式为
③操作I为
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
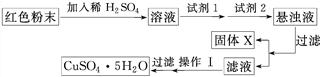
实验小组设计如下实验方案:

试回答:
①试剂1为________(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。
查看习题详情和答案>>
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
试回答:
①试剂1为________(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。 查看习题详情和答案>>
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是______.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______简述你的理由(不需写出反应的方程式 )______.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是______,写出发生反应的离子方程式______.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为______.
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:
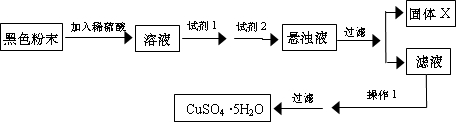
试回答:
①试剂I为______,试剂II为______(填字母).
②固体X的化学式为______.
③操作I为______. 查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是______.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______简述你的理由(不需写出反应的方程式 )______.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是______,写出发生反应的离子方程式______.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为______.
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:
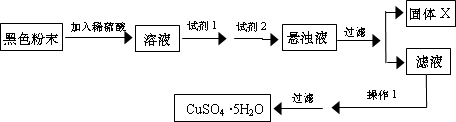
试回答:
①试剂I为______,试剂II为______(填字母).
②固体X的化学式为______.
③操作I为______.









