摘要:1.(NH4)2CO3 水解离子方程式为:NH4++CO3 2- +H2O HCO3-+NH3.H2O
网址:http://m.1010jiajiao.com/timu_id_411941[举报]
(1)一定温度下,在2L的密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化如下表:
①用SO2表示0~4min内该反应的平均速率为
②若升高温度,平衡常数K值
③下列有关反应的说法正确的是
A.反应在第4分钟时已达到平衡状态
B.保持容器体积不变,当混合气体的密度不变时,说明反应已达平衡状态
C.达平衡状态后,缩小容器的体积,正反应速率增大,逆反应速率变小
D.通入过量O2,SO2的转化率将增大
(2)在亚硫酸氢钠溶液中,既存在 HSO3- 的电离平衡:HSO3-?H++SO32-,也存在 HSO3- 的水解平衡,
①其水解离子方程式为
②已知在 0.1mol?L-1 的 NaHSO3 溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).则该溶液中 c(H+)
查看习题详情和答案>>
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
0.025mol/(L?min)
0.025mol/(L?min)
.②若升高温度,平衡常数K值
变小
变小
(填“变大”、“变小”或“不变”).③下列有关反应的说法正确的是
AD
AD
(填序号)A.反应在第4分钟时已达到平衡状态
B.保持容器体积不变,当混合气体的密度不变时,说明反应已达平衡状态
C.达平衡状态后,缩小容器的体积,正反应速率增大,逆反应速率变小
D.通入过量O2,SO2的转化率将增大
(2)在亚硫酸氢钠溶液中,既存在 HSO3- 的电离平衡:HSO3-?H++SO32-,也存在 HSO3- 的水解平衡,
①其水解离子方程式为
HSO3-+H2O?OH-+H2SO3
HSO3-+H2O?OH-+H2SO3
.②已知在 0.1mol?L-1 的 NaHSO3 溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).则该溶液中 c(H+)
>
>
c(OH-) (填“<”“>”“=”).按要求写出下列方程式:
NaHSO4电离方程式:
NaHCO3电离方程式:
HClO电离方程式:
NH3?H2O电离方程式:
Na2S水解离子方程式:
AlCl3水解离子方程式:
查看习题详情和答案>>
NaHSO4电离方程式:
NaHSO4═Na++H++SO42-
NaHSO4═Na++H++SO42-
NaHCO3电离方程式:
NaHCO3═Na++HCO3-
NaHCO3═Na++HCO3-
HClO电离方程式:
HClO?H++ClO
HClO?H++ClO
NH3?H2O电离方程式:
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
Na2S水解离子方程式:
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
AlCl3水解离子方程式:
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
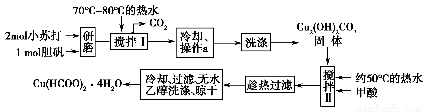
回答下列问题:
(1)小苏打水溶液显________性(填“酸”、“碱”或“中”)可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为________________________。
(2)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为________________________。
(3)操作a的名称是________,该操作使用的玻璃仪器有________。
(4)证明碱式碳酸铜已经洗涤充分的实验操作是________________________________。
(5)用无水乙醇洗涤晶体的目的是___________________________________。
查看习题详情和答案>>
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。已知A的一种核素的质量数等于其质子数;E原子最外层电子数为其电子层数的两倍,C、E是同主族元素;B的第一电离能大于C的第一电离能;D离子在同周期离子中半径最小。G的最外层电子排布图为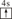 ,其余各能层电子全充满。
,其余各能层电子全充满。
(1)画出B原子的结构示意图____,G+离子的电子排布式为_____。
(2)C与E组成的一种化合物具有漂白性,该化合物分子中中心原子的VSEPR构型为 。
(3)D单质具有良好导热性的原因是____。
(4)E、F的最高价氧化物对应的水化物的酸性强弱比较(填写化学式):_____>_____。
(5)G单质的晶胞结构如图所示,则一个晶胞中G的原子个数为_____。
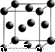
(6)A与B形成的10电子阳离子在重水中的水解离子方程式为____。
查看习题详情和答案>>