网址:http://m.1010jiajiao.com/timu_id_409008[举报]
Ⅰ实验基本操作
一、选择题
1.
2
3
4
5
6
7
8
9
10
11
12
13
B
D
D
C
A
C
D
D
A
B
B
C
BD
14
15
16
17
18
19
20
21
22
23
24
25
26
B
C
C
B
D
AD
B
C
C
C
D
A
D
二、填空题
27.(1)A① B.③⑤ C.⑦ (2)减少苯的挥发(或“起冷凝器作用”)
28.(1)a b (2)c d (3)B (4)②⑥
29.(1)②⑦ (2)⑥ (3)④⑤⑧
30.AD
31.(1)肯定存在Mg2+、Al3+、NO3-、SO2-4,肯定不存在Fe2+、Ba2+、HCO-3(2)用焰色反应确定K+存在;用原溶液、Ba(NO3)2溶液、稀HNO3和AgNO3溶液作沉淀反应来确定Cl的存在。
32.(1)A.酸性KMnO4溶液,除H2S,C2H2 B.NaOH溶液,除CO
B中盛饱和Na2CO3溶液,Na2CO3+CO2+H2Oㄔ2NaHCO3
33.(1)C→B→D→A→G→H→E→F
(2)E步骤:应使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出
G步骤:使漏斗内外空气相通,以保证E操作时,漏斗里的液体能够流出
(3)CCl4与水不互溶,且碘在CCl4中的溶解度比在水中大很多
(4)AC
34.(1)KCl,AgNO3。混合时只生成一种沉淀的是KCl,生成的是AgCl,所以A是KCl,G是AgNO3。
(2)B:NaSO
Ⅱ常见气体的实验室制法
一、选择题
1
2
3
4
5
6
7
8
9
C
B
BD
D
AD
C
C
C
C
二、填空题
10.(1)关闭弹簧夹时,反应产生的气体使试管内液面上的压力增加,所以液面下降。
(2)塞紧橡皮塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气。
(3)
二氧化碳
向上排空气法
通入澄清石灰水中使石灰水变浑浊
硫化氢
向上排空气法
有臭鸡蛋味
(4)因为:此反应需要加热 食盐是粉末状
11.(1)2NaBr+2H2S04+Mn02?2NaHSO4+MnSO4+2H20+Br2↑
或2NaBr+2H2S04+Mn02?Na2HSO4+MnSO4+2H20+Br2↑
若分步写应为:NaBr+H2S04(浓)?NaHSO4+HBr↑
或2NaBr+H2S04(浓)?NaSO4+2HBr↑
4HBr+MnO2(浓)?MnBr2+2H2O+Br2↑
冷凝.吸收未冷凝的气体
(2)溴蒸气会腐蚀橡皮塞和橡皮管
(3)当气体被吸收时,液体上升到漏斗中。由于漏斗的容积较大,导致烧杯中液面下降.使漏斗口脱离液面,漏斗中的液体又流回烧杯中,从而防止了倒吸。
12.(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③ (3)慢慢将量筒下移
(4)[
 |
13.(1)CH3CH2OH CH2↑+H2O
CH2=CH2+Br2→CH2BrCH2Br
(2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出。
(3)除去乙烯中带出的酸性气体,(或除去CO2,SO2)
(4)原因:①乙烯发生(或通过液溴)速度过快,②实验过程中,乙烯和浓H2SO4,的混合液没有迅速达到
14.(1)2NH4Cl+Ca(OH)2?2NH3↑+CaCl2+2H2O
(2)向下排空气 碱石灰 (3)打开止水夹,挤出胶头滴管中的水
(4)打开夹子。用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
15.(1)4HCl+MnO2?MnCl2↑+2H20+Cl2↑或16HCl+2KMn04ㄔ2KCl+2MnCl2+8H20+5Cl2↑
(2)B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D
(3)2Fe+3Cl2?2FeCl3
(4)导管易被产品堵塞;尾气排人空气,易造成环境污染
(5)产品易受潮解。在瓶E和F之间连接装有干燥剂的装置
16.(1)NO
(2)①C2H4 装置中没有温度汁,无法控制反应温度
②C12 反应生成的Cl2被c中的NaOH溶液吸收了
③NH3反应生成的NH3被c中的H2O吸收了
17.Ⅰ.制化肥、制硝酸 Ⅱ.②④
Ⅲ.(1)排除空气,保证安全
(2)锌粒与酸脱离 尽量增大氢气的浓度以提高氨气的转化氯 N2 H2
(3)铁触媒在较高温度时活性增大,加快氨合成的反应速率
N2+3H2 2NH3
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
专题二非金属元素及其化合物
一、选择题
1.目前,我国城市环境污染中的大气污染物主要是 ( )
A.NH3、NO、CO2、雾 B.CO2、N2、Cl2、酸雨
C.SO2、NO2、CO、烟尘 D.HCl、SO2、N2、沙尘暴
2.宣传科学知识,介绍高新科技,揭露伪科学,是科学工作者的义务,下列各项中学的是)
A.高温高压下将石墨制成金刚石 B.用催化剂将水变成燃料油
C.将空气中游离的氮变成氮的化合物 D.用碘化银人工降雨
3.石墨炸弹爆炸时,能在方圆几百米范围内撤下大量石墨纤维,造成输电线、电厂设备损失,这是由于石墨 ( )
A.有放射性 B.易燃、易爆 C.能导电 D.有剧毒
4.国外有人用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射N2,此时碳氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬,其原因可能是 ( )
A.碳、氮原子构成网状结构的晶体 B.碳氮键比金刚石中的碳碳键更短
C.氮原子最外层电子数比碳原子最外层电子数多 D.碳、氮的单质化学性质均不活泼
5.氯胺(NH2Cl)在中性或酸性条件下是一种有效的强力消毒剂,据此判断,氯胺在水溶液中因水解产生的物质是 ( )
A.HCl0和HCl B.NH
6.下列各组物质均由一种干燥气体和一种液体组成,其中可以进行喷泉实验,且液体几乎充满烧瓶的组合是 ( )
A.Cl2,饱和食盐水 B.SO2 氨水 C.NH3,稀盐酸 D.NO2 水
7.1999年曾报导合成和分离了含高能量的正离子N5+的化合物N5ASF6,下列叙述错误的是
A.N5+共有34个核外电子 B.N5+中N-N原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+l价 D.化合物N5AsF6中F化合价为-1价
8.为了同时施用分别含有氮、磷、钾3种元素的化肥,对于下列化肥:①草木灰 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,适宜的组合是 ( )
A.①③④ B.②③④ C.①③⑤ D.②③⑤
9.常见的污染物分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理、化学因素或微生物作用下,发生变化所生成的新污染物。如反应2NO+O2ㄔ2NO2中,二氧化氮为二次污染物。下列三种气体:①二氧化硫②二氧化氮③硫化氢,其中能生成二次污染物的是 ( )
A.只有①② B.只有②③ C.只有①③ D.全部都是
lO.在
A.1:1:1 B.5:5:
11.在一种酸性溶液中,存在NO3-、I一、Cl一、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中 ( )
A.一定有碘离子,不能确定是否含有氯离子 B.一定含有硝酸根离子
C.一定含有碘离子、氯离子、硝酸根离子 D.不含铁离子和硝酸根离子
12.市售“家用消毒液发生器”是以精盐和自来水为原料。通电时,发生器内的电极板上产生大量气泡(同时使产生的气体充分与电解液接触),所制得的混合液具有强烈的杀菌能力,且不致对人体造成伤害。该发生器配制消毒液所涉及到的化学反应有 ( )
①2NaCl+2H2O
 NaOH+H2↑+Cl2↑ ②Cl2+2NaOHㄔNaCl+NaClO+H20
NaOH+H2↑+Cl2↑ ②Cl2+2NaOHㄔNaCl+NaClO+H20
③H2+Cl2ㄔ2HCl ④Cl2+H20ㄔHCl+HClO ⑤2HClOㄔ2HCl+O2
A.①④⑤ B.①② C.③④⑤ D.②③④
13.工业上常用氨碱法制取纯碱,是将氨和二氧化碳先后通入饱和食盐水而析出小苏打,再经过滤,焙烧而得纯碱。但不能用氨碱法制取碳酸钾,原因可能是 ( )
A.KHCO3溶解度较大 B.KHCO3溶解度较小
C.K2CO3溶解度较小 D.K2CO3溶解度较大
14.氮化铝(AlN)熔融时不导电,常用作砂轮及耐高温材料,由此推知,它属于( )
A.离子晶体 B.原子晶体 C.分子晶体 D.无法判断
15.航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法错误的是 ( )
A.C2O3和CO2都是碳元素的氧化物 B.C2O3和C02都是碳酸的酸酐
C.C2O3和C0都具有还原性 D.C2O3和C0燃烧产物都是C02
16.以下说法中能证明无色透明液体是纯净水的是 ( )
A.测得该液体pH=7
B.电解该液体得到氢气和氧气,且其体积比为2:1
C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声
D.在l
17.将足量C02通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入C02体积(V)的关系正确的是 ( )
 |
18.在常温下四个容积相同的抽空的密闭容器内,分别注入下列各组气体(先注入一种,再注入另一种),全部气体注入完毕后,容器中的压强从大到小的顺序是 ( )
①2mol氢气和1mol氧气 ②2mol硫化氢和1mol二氧化硫
③2mol一氧化氮和1mol氧气 ④2mol氨和lmol氯化氢
A.①=②=③>④ B.①>②=③>④ C.③>④>①>② D.①>③>④>②
19.向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl Na2S04 B.NaCl NaBr Na2S
20.下图中,锥形瓶内盛有气体x,滴管内盛有液体y,若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中正确的是 ( )
 A.x是NH3,y是浓氨水 B.x是S02,y是氢氧化钠浓溶液
A.x是NH3,y是浓氨水 B.x是S02,y是氢氧化钠浓溶液
C.x是C02,y是稀硫酸 D.x是HCl,y是NaN03稀溶液
21. X(盐)和Y(酸)反应,可放出有气味的气体Z;Z跟NaOH反应又得到X(盐);Z氧化的最终产物为W气,W气溶于水又得到Y(酸)。则 X(盐)和Y(酸)是 ( )
A.Na2S和稀硫酸 B.Na2SO3和盐酸 C.Na2S和盐酸 D.Na2SO3和稀硫酸
22.将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是 ( )
A.CO2 B.NH
23.治理太湖污染是我国目前重要的环保工程,措施之一是在太湖流域推广无磷洗衣粉,这是继无氟冰箱、无铅汽油推广以来又一重要“绿色化工产品”,下列关于磷污染说法不正确的是 ( )
A.磷是营养元素,促进鱼类大量繁殖 B.磷是有毒物质,杀死水中的动植物
C.磷导致藻类疯长,鱼类因缺氧而无法生存 D.磷促进水中动植物尸体的分解
二、填空题
1.油画中的白色颜料是铅白[Pb3(OH)2(C03)2],油画在空气中长期放置,由于空气中极少量的H2S作用,其白色部位可能变黑,这一反应的化学方程式为 。用过氧化氢水溶液小心擦拭变黑处,可恢复白色。其化学方程式为 。
2.在一烧杯中盛有100mL2mol?L-1的H2SO4溶液,溶液中有一表面光滑的塑料小球漂浮在溶液中央(如下图所示)。向此烧杯中缓缓注入0.4 mol?L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中:
(1)可观察到的实验现象有:
① ;
② ;
(2)产生上述现象的原因是: 。
(3)实验中反应的离子方程式是: 。
3.为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:
4.减少汽车尾气造成环境污染的方法之一是在汽车的排气管上安装“催化转换器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧和SO2的转化。
(1)写出CO与NO反应的化学方程式: 。
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是 。
5.环保检测中,有害气体的浓度常用
①首先将
②用30.0mL5.00×10-3mol/L的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
I2+2S2032- =2I-+S4O62-;
③将②中溶液取出1/5,加入1.00mLl.00×10-2mol/L碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化。
(1)写出步骤①中CO通过盛I2O5加热管的有关反应的化学方程式。
(2)计算样品中CO的浓度。
6.用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2。
(1)使用ClO2作饮用水消毒剂的优点是:
(2)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是:
(3)我国最近研究成功ClO2氧化亚氯酸钠(N2保护下)制ClO2,其反应的化学方程式为:
这一反应的优点是:
(4)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
7.如下图所示,已知:
 |
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成 X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比l:2反应,分别生成Z和W,在产物中元素乙呈负价;
请填空:
(1)甲是 , 乙是 。
(2)甲与丙反应生成X的化学方程式是:
(3)乙与丁反应生成W的化学方程式是:
8.如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下
 转化关系:
转化关系:
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是 (填写物质的化学式);
②此时,Z是 气的主要成分;
③X与甲反应的化学方程式是
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。试推断:
①写出甲、乙、丙三种物质的化学式 ;
②写出X与足量的甲在溶液中完全反应的离子方程式 。
9.X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
。
参考答案
一、选择题
1
2
3
4
5
6
7
8
9
10
11
12
C
B
B
AB
C
BC
C
B
D
A
AD
A
13
14
15
16
17
18
19
20
21
22
23
A
B
B
D
D
D
AB
BD
A
A
C
二、填空题
1. Pb3(OH)2(CO3)2+H2Sㄔ3PbS+4H2O+2CO2
PbS+4H2O2ㄔPbSO4+4H2O
2.(1)①溶液中出现白色沉淀;②小球沉到烧杯底(2)向硫酸中加入氢氧化钡溶液至恰好完全反应,产生硫酸钡的白色沉淀,此时烧杯中的液体只是水,其密度比2mol?L-1硫酸密度小,则原悬浮与烧杯中央的小球沉到水底(小球的密度与2mol?L-1硫酸的密度几乎相同)
3.CaO+SO2ㄔCaSO3;2CaSO3+O2ㄔCaSO4
4.(1)2CO+2NOㄔN2+2CO2 (2)使SO2转化为SO3 3,SO2+H20ㄔH2SO4产生硫酸烟雾
5.(1)5CO+I2O5ㄔI2+5CO2
(2)根据5CO+I2O5ㄔI2+5CO2和I2+2S2O2-3ㄔ2I-+S4O62-
CO的浓度:1.75mg/L
6.(1)ClO2有强氧化性,为高效消毒剂,不与有机物发生加成和取代反应
(2)2NaClO3+4CHl(浓)Cl2↑+ClO2+2NaCl+2H2O
(3)Cl2+2NaClO2ㄔ2ClO2+2NaCl
(4)Na2SO3+2NaClO3+H2SO4ㄔ2ClO2+2Na2SO4+H20
7.(1)N2,O2
点燃
(2)N2 + 3Mg == Mg3N2
点燃
(3)O2 + 2H2 == 2 H2O (或将其换位)
8.(1)①CO2、CO ②CO ③ CO2 + 2Mg == C + 2MgO
(2)①Cl2、Fe、Br2
9.(1) ①H2 ② NH3 + HCl == NH4Cl
(2) ① SO2 ② H2S + OH- == HS- + H2O
③ S+3Cl2 + 4H2O == H2SO4 + 6HCl
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
专题三基础计算
Ⅰ.有关物质的量的计算
一、选择题
1.质量相等的两份气体样品,一份是CO,另一份是CO2,这两份气体样品中,CO与CO2所含氧原子的原子个数之比是 ( )
A.1:2 B.1:
2.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相同、密度相等的CO和C2H4 D.压强相同、体积相同的O2和H2
3.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为 ( )
A.2:l B.1:l C.1:2 D.1:3
4.由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 ( )
A.29:8:13 B.22:l:
5.由X、Y两元素组成的气态化合物XY4,在一定条件下完全分解为A、B两种气体物质,己知标准状况下20mLXY4分解可产生标准状况下30mL A气体(化学式为Y2)和10mL B气体,则B的化学式为 ( )
A.X2 B.Y2X
6.将N02、NH3、O2混合气22.
A.28.1 B.
7.为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理的是 ( )
A.H2SO4? B.H2SO4
?H2O C.H2SO4?SO3
D.SO3?
B.H2SO4
?H2O C.H2SO4?SO3
D.SO3?  H2O
H2O
8.两种气态烃组成的混合气体0.1mol,完全燃烧得O.16molCO2 T
A.一定有甲烷 B.一定是甲烷和乙烯 C.一定没有乙烷 D.一定有乙炔
 |
 |
 |
 |
9.用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时生b L氧气(标准状况),从而可知M的原子量为 ( )
lO.b g某金属与足量的稀硫酸反应,生成该金属的三价正盐和a g氢气。该金属的相对原子质量为
 |
 |
 |
 |
11.下列叙述正确的是
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.
D. 等体积、等物质的量浓度的强酸中所含的H+ 数一定相等
12.下列说法不正确的是 ( )
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1
C.
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.
13.用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.0.1mol?L-1稀硫酸100mL中含有硫酸根个数为0?1NA
B.1mol CH3+(碳正离子)中含有电子数为10NA
C.
D.
14.NA代表阿伏加德罗常数值,下列说法正确的是 ( )
A.
B.1molMgCl5中含有离子数为NA
C.
D.1molC10H22分子中共价键总数为31NA
15.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2Oㄔ7Cu2S+5FeSO4+12H2SO4,下列说法正确的是 ( )
A. Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C. 产物中的SO42-离子有一部分是氧化产物
D. FeS2只作还原剂
16.在
A.2H2S+02ㄔ2H2O+2S B 2H2S+3O2ㄔ2H2O+2SO2
C.C2H4+3O2ㄔ2H2O+2CO2 D.C4H8+6O2ㄔ4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合系式d前=d后和P前>P后的是 ;符合关系式d前=d后和P前=P后的是 (请填写反应的代号)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合系d前>d后和V前>V后的是 ;符合d前>d后和V前>V后的是 (请填写反应的代号)。
17.标准状况下
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
18.将一定量由C、H、O三种元素组成的有机化合物A的蒸气与
Ⅱ有关溶液的计算
一、选择题
1.300mL某溶液的NaOH溶液中含有
A.1:4 B.1:
2.有三种不同浓度的稀硫酸、体积比较依次为3:2:l,它们分别与等物质的量的K2CO3、KHC03、Al恰好完全反应。这三种硫酸的浓度之比是 ( )
A.1:l:l B.6:2:
3.乙知25%氨水的密度为O
A.等于15% B.大于15% C.小于15% D.无法估算
4.用0.1mol•L-1NaOH溶液滴定O.1 mol•L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液
(l滴溶液的体积约为0.05mL),继续加水至50ml,所得溶液的pH是 ( )
A.4 B.7.
5.有五瓶溶液分别是:①l0mL0.60mol•L-1 NaOH水溶液,②20mL0.50 mol•L-1H2SO4。③30mLO .4 mol•L-1 HCl④40mL0.30 mol•L-1HAc水溶液,⑤50ML0.20 mol•L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
6.pH=9的Ba(OH)2溶液与pH=12的KOH溶液。按4:1的体积比混合,则混合溶液中的氢离子浓度(mol•L-1)是 ( )
A.1/5(4×l09+1×10-12) B.1/5(4×10-15+1×10-2)J
C.5×10-9 D.5×lO-12
7.在硫酸铝、硫酸钾和明矾的混合溶液中,如果[SO42-]=O.2 mol•L-1,当加等体积的O.2 mol•L-1的KOH溶液时,生成沉淀恰好溶解,则原混合物中K+的浓度是 ( )
A.0.2 mol•L-1 B.O.25 mol•L
8.在
A.大于100mL B.等于100mL C.大于100mL D.等于100/p mL
 |


 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:

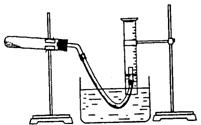 ①装好实验装置。②检查装置气密性。③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
①装好实验装置。②检查装置气密性。③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。