摘要:(3)若不使用热交换器.欲使80℃的SO2.O2预热到430℃.每年需提供的热量为20×103kg×365×0.8kJ/×(430℃-80℃)=2.04×109kJ.每千克优质煤供给的有效热量为5240kJ/kg.使用热交换器后每年可节约优质煤的质量为:2.04×109kJ/=389.3t.
网址:http://m.1010jiajiao.com/timu_id_404579[举报]
工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)上述流程中可以循环使用的物质有 、 (写化学式)。(3)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
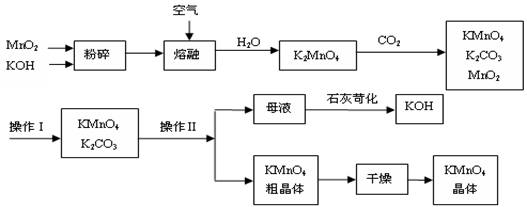 (4)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(4)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
查看习题详情和答案>>
(2009?梅州模拟)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.001mol?L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol?L-1)的用量均为2mL.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
计算用0.001mol?L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
查看习题详情和答案>>
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和 ③ ③ 探究温度对该反应速率的影响;(Ⅲ)实验①和 ④ ④ 探究催化剂对该反应速率的影响;) |
| ② | 298 298 |
0.5 0.5 |
0.001 0.001 | |
| ③ | 323K 323K |
0.5 0.5 |
0.01 0.01 | |
| ④ | 298 298 |
0 0 |
0.01 0.01 |
| KMnO4酸性溶液 的浓度/mol?L-1 |
溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
1×10-4mol?L-1?min-1
1×10-4mol?L-1?min-1
(忽略混合前后溶液的体积变化,写出计算过程).(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
不可行
不可行
.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.(3分)
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.(3分)
.(共6分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学反应方程式为 ;
(2)反应开始至2minZ的平均反应速率为 ;
(3)若不改变外界条件,5min ~ 6min Z的生成速率(V1)与6min后Z的生成速率(V2)的大小关系为:V1 V2(填大于、小于或等于)。
查看习题详情和答案>>

