网址:http://m.1010jiajiao.com/timu_id_404509[举报]
一、选择题
1.AC 2.A 3.B 4.B 5.D 6.BC 7.BD 8.A 9.BD 10.D
二、填空简答
1. Cl-, S2-、I- 、Br-、SO32-
2.(1)H+、Cl-或SO42-或Cl-和SO42- ,Cu2+、OH-、NO3-、HCO3-、Ag+
(2)Ba2+、OH-, Cu2+、H+、Mg2+、Ag+、HCO3-、SO42- 可能存在:Cl-、NO3-
3.Fe3+、SO42-, Ba2+、Al3+、NH4+、I-、HCO3-、SO32-, K+、Cl-、NO3-
4.Al3+、SO42-, NH4+、Mg2+、Fe2+、Cl-、CO32- ,K+、NO3-
5.OH-、Cl-、K+, Ag, K+、NO3-
参考答案(二)
一、选择题
1.C 2.CD 3.C 4.AD 5.C 6.AC 7.B 8.BC 9.D 10.CD 11.AC 12.A
二、填空简答
1. (1)NH4++D2O ㄐ NH3?HDO + D+
(2)Fe3++3H2O =Fe(OH)3(胶体) +3H+
2.(1)Ag -e+=Ag+;Ag++Cl-=AgCl(2)2H++2e=H2↑;Mg2++2OH-=Mg(OH)2↓
3.I-、Fe2+,Br-、Fe3+,Cl- ,2I-+Br2 = I2 + 2Br-、2Fe2++Br2 =2 Fe3++ 2Br-
4. Fe2+ 、NH4+,
Mg2++2OH-=Mg(OH)2↓、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2 +O2+2H2O = 4Fe(OH)3 、Al3++3 OH-=Al(OH)3↓、NH4++OH-=NH3↑+H2O 、Mg(OH)2+2H+=Mg2++2H2O、Fe(OH)3+3H+=Fe3++3H2O、Al (OH)3+3H+=Al3++3H2O
5. Fe2+、 Ag+,
Mg2++2 NH3?H2O=Mg(OH)2↓+2NH4+、Fe2++2 NH3?H2O=Fe(OH)2↓+2NH4+、
4Fe(OH)2 +O2+2H2O = 4Fe(OH)3 、Al3++3NH3?H2O=Al(OH)3↓+3NH4+ 、Ag+ +2 NH3?H2O=Ag(NH3)2++2H2O、Mg(OH)2+2H+=Mg2++2H2O、Fe(OH)3+3H+=Fe3++3H2O、Al (OH)3+3H+=Al3++3H2O、Ag(NH3)2++2H++Cl-=AgCl↓+2NH4+
甲同学:为制备84消毒液,制作了一种家用环保型消毒液发生器,设计了如图1所示的装置,用石墨作电极电解饱和氯化钠.请填空:
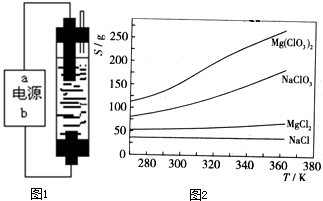
(1)若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a极名称为
(2)用图示的装置电解饱和食盐水制备84消毒液(NaClO溶液)的离子方程式为
| ||
| ||
| ||
| ||
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品.本品须密封,置阴凉暗处保存.
请完成以下实验探究过程:
阅读材料,根据学过的知识判断问题:
(3)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是(用离子方程式表示)
(4)查得弱酸的电离常数:H2CO3K1=4.4×10-7,K2=4.7×10-11;HClO K=3×10-8.
从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示):
| ||
| ||
Ⅱ.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
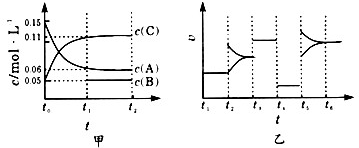
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为
| c(B)?c2(C) |
| c3(A) |
| c(B)?c2(C) |
| c3(A) |
(2)若t5时改变的条件是升温,此时v(正)>v(逆),平衡常数K的值将
(3)若 t1=15s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=
(4)t3 时改变的某一反应条件可能是
a.使用催化剂 b.增大压强 c.增大反应物浓度
(5)若A 的物质的量减少 0.03mol时,容器与外界的热交换总量为 akJ,写出该反应的热化学方程式
 (2011?泰州二模)下列有关溶液中粒子浓度的关系式中,正确的是( )
(2011?泰州二模)下列有关溶液中粒子浓度的关系式中,正确的是( )