网址:http://m.1010jiajiao.com/timu_id_404425[举报]
一、1.B 2.A?
3.解析:v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6。
答案:D?
4.BC 5.B 6.B 7.D 8.BD?
9.解析:由①②组数据解得m=1,由②③组数据解得n= 。
。
答案:D
二、10.(1)0.013 (2)1.0 催化剂 (3)> >
(4)吸热 温度升高时,平衡向右移动?
11.①
12.④>③=②>①?
13.
 (
( -x)?mol?L-1?min-1
-x)?mol?L-1?min-1
14.(1)1∶50 根据勒夏特列原理,通入过量而廉价的氧气,可提高SO2的转化率
(2)废气中每小时排出的SO2的体积为:1
(3)SO2 ~ 2NH3 ~ (NH4)2SO4?
 mol?
mol?
 mol
mol
 mol
mol
故可得(NH4)2SO4: mol×1
mol×1
消耗氨气: mol×2×1
mol×2×1
|
在2 L密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g)+O2 | |
A. |
1.6 mol |
B. |
1.2 mol |
C. |
大于1.6 mol |
D. |
小于1.2 mol |
 2SO3(g),进行到4min时,测得n(SO2)=1.2 mol。下列说法正确的是
2SO3(g),进行到4min时,测得n(SO2)=1.2 mol。下列说法正确的是 B.当v(SO2):v(O2):v(SO3)=2:1:2时该反应达平衡状态
C.温度升高时正反应速率升高,逆反应速率降低
D.4 min内氧气的平均反应速率为0.5mol·L-1·min-1
在2 L的密闭容器中充入一定量的SO3,在一定温度和催化剂作用下,发生反应:2SO3![]() 2SO2+O2,4 min测得n(O2)=0.8 mol,n(SO3)=6.4 mol.
2SO2+O2,4 min测得n(O2)=0.8 mol,n(SO3)=6.4 mol.
求:(1)n(SO2);
(2)氧气的生成速率v(O2);
(3)SO3的转化率;
在2 L的密闭容器中充入一定量的SO3,在一定温度和催化剂作用下,发生反应:2SO3![]() 2SO2+O2,4 min测得n(O2)=0.8 mol,n(SO3)=6.4 mol.
2SO2+O2,4 min测得n(O2)=0.8 mol,n(SO3)=6.4 mol.
求:(1)n(SO2);
(2)氧气的生成速率v(O2);
(3)SO3的转化率;
(12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示: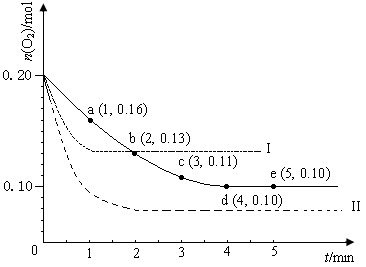
(1)用SO2表示0~4 min内该反应的平均速率为 。该温度下反应的平衡常数K为 。升高温度K值 (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度
(填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),SO3的体积分数 (填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。