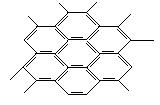
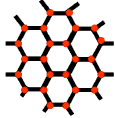
摘要:石墨晶体如图所示.每一层由无数个正六边形构成.则平均每个正六边形所占有的碳原子数为?
网址:http://m.1010jiajiao.com/timu_id_404014[举报]
一、1.C 2.A 3.C?
4.解析:比较物质熔、沸点高低时,首先判断晶体类型。一般是,原子晶体>离子晶体>分子晶体;然后比较同一类型晶体中,粒子间的作用力。共价键比键长,离子键看离子半径和电荷数,分子间作用力主要比分子量的大小。(注意氢键的存在)?
答案:B?
5.D 6.D 7.B?
8.解析:每一个环内电子数为3×5+3×7=36,与石墨层中一个环内电子数6×6=36是相同的,故与石墨为“等电子体”,性质类似石墨。?
答案:B?
9.解析:每个碳原子为三个六元环所共有,则每个正六边形所占有的碳原子数为6× =
=
2个。
答案:D?
10.D 11.B?
二、12.6 109°28′ 2 W??

2Na2O2+2H2O===4NaOH+O2↑?
(5)离子 S2-+H2O HS-+OH- HS-+H2O
HS-+OH- HS-+H2O H2S+OH-?
H2S+OH-?
16.(1)密度= g?cm-3?
g?cm-3?
(2)6∶91