摘要:[解析]根据质量守恒定律.当16gA与22gB恰好反应生成4.5gD的同时.生成C的质量应为16+22-4.5=33.5g.当8gA和15gB反应时.根据判断B是过量的.A与C的质量关系应是16:33.5=8:x.x=16.75g.MC=16.75g/0.125mol=134g/mol.即C的式量为134.[例3]下列说法正确的是(NA表示阿伏加德罗常数)
网址:http://m.1010jiajiao.com/timu_id_403860[举报]
(1)下列说法正确的是
A.油脂水解可得到氨基酸和甘油
B.用酸性KMnO4溶液可以鉴别甲烷与乙烯
C.CH4和C5H12一定互为同系物
D.在蛋白质溶液中加入硫酸铜溶液,蛋白质会发生凝聚,加水后又能溶解
(2)某有机物X中碳的质量分数约为83.72%,此有机物蒸气在相同条件下是同体积氢气质量的43倍,若X结构中含有2个甲基,则X的结构简式为
(3)苯可以和浓硫酸发生取代反应生成苯磺酸( ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为
查看习题详情和答案>>
BC
BC
A.油脂水解可得到氨基酸和甘油
B.用酸性KMnO4溶液可以鉴别甲烷与乙烯
C.CH4和C5H12一定互为同系物
D.在蛋白质溶液中加入硫酸铜溶液,蛋白质会发生凝聚,加水后又能溶解
(2)某有机物X中碳的质量分数约为83.72%,此有机物蒸气在相同条件下是同体积氢气质量的43倍,若X结构中含有2个甲基,则X的结构简式为
CH3CH2CH2CH2CH2CH3
CH3CH2CH2CH2CH2CH3
.(3)苯可以和浓硫酸发生取代反应生成苯磺酸(
 ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为H2O
H2O
.煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O
4H++2Fe2++
②4Fe2++O2+4H+
4Fe3++
③FeS2+2Fe3+
3Fe2++2S;
④2S+3O2+2H2O
4H++2S
.
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是
(3)观察上述反应,FeS2最终转化为
查看习题详情和答案>>
①2FeS2+7O2+2H2O
| ||
4SO42-
4SO42-
;②4Fe2++O2+4H+
| ||
2H2O
2H2O
;③FeS2+2Fe3+
| ||
④2S+3O2+2H2O
| ||
| O | 2- 4 |
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是
FeS2
FeS2
.(3)观察上述反应,FeS2最终转化为
FeSO4 H2SO4
FeSO4 H2SO4
从煤炭中分离出来.如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是
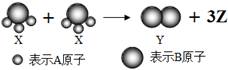
A.根据质量守恒定律可推知,1个Z分子中含有2个A原子
B.该反应属于分解反应
C.该反应属于氧化还原反应
D.X、Y、Z三种物质均属于非电解质
查看习题详情和答案>>
如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是

A.根据质量守恒定律可推知,1个Z分子中含有2个A原子
B.该反应属于分解反应
C.该反应属于氧化还原反应
D.X、Y、Z三种物质均属于非电解质
查看习题详情和答案>>
(8分)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O  4H++2Fe2++________;
4H++2Fe2++________;
②4Fe2++O2+4H+ 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
已知:FeS2中的铁元素为+2价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来。