网址:http://m.1010jiajiao.com/timu_id_403848[举报]
 (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
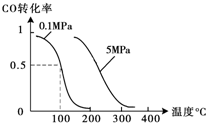
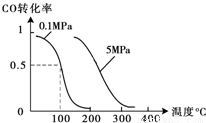
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H
②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
(3)实验室中配制AgNO3溶液时通常需要向其中加入
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:______.
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H______0(填“<”、“>”或“=”).
②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”).
(3)实验室中配制AgNO3溶液时通常需要向其中加入______,目的是______; AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag+(aq)+Cl-(aq).25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol?L-1AgNO3溶液;③100mL 0.1mol?L-1氯化镁溶液;④100mL 0.1mol?L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号).
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:______.
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H______0(填“<”、“>”或“=”).
②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”).
(3)实验室中配制AgNO3溶液时通常需要向其中加入______,目的是______; AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag+(aq)+Cl-(aq).25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol?L-1AgNO3溶液;③100mL 0.1mol?L-1氯化镁溶液;④100mL 0.1mol?L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号).
 查看习题详情和答案>>
查看习题详情和答案>>
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
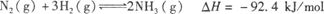 ,据此回答以下问题:
,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
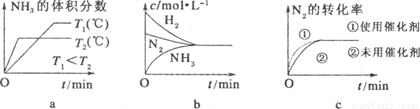
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。
查看习题详情和答案>>
合成氨工业对国民经济和社会发展具有重要的意义。其原理为: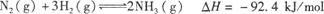 ,据此回答以下问题:
,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。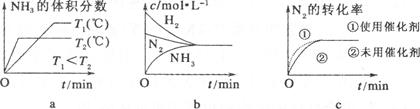
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。