摘要:①反应从逆反应方向开始.则D的起始物质的量应满足的条件是
网址:http://m.1010jiajiao.com/timu_id_403412[举报]
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
C
A
C
C
题号
9
10
11
12
13
14
15
答案
D
B
D
D
D
A
B
16.⑴ 2,4 ⑵相等,0.6 ⑶① n(D)>4/3 mol ② n(C)=3.6mol n(D) >17/15mol
⑷8∶5
17.10-14;10-12;1:9;pH(酸)+pH(碱)=13
18.⑴ 2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
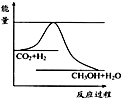

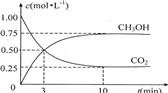
 3C(g)+D(s),达到平衡时,C的浓度为1.2mol?L-1。试填写下列空白:
3C(g)+D(s),达到平衡时,C的浓度为1.2mol?L-1。试填写下列空白: 2NO2(g),ΔH=+57 kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是__________
2NO2(g),ΔH=+57 kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是__________ 

 N2O4的平衡常数K将_________(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_________(填“增大”、“减小”或“不变”)。