摘要:请回答下列问题:(1)写出上述流程中所涉及的化学工业名称 ,(2)反应I需在500℃进行.其主要原因是 ,H转化为I的过程中.需不断补充空气.其原因是 ,(3)写出反应Ⅲ的化学方程式 , 工业上.采用向析出K的母液中通氨气.加入细小食盐颗粒.冷却后可析出副产品.通氨气的作用是 . a.增大NH4+的浓度.使J更多地析出 b.使K更多地析出 c.使K转化为M.提高析出的J的纯度
网址:http://m.1010jiajiao.com/timu_id_401956[举报]
下图表示某些化工生产的流程(有的反应条件和产物已略去)
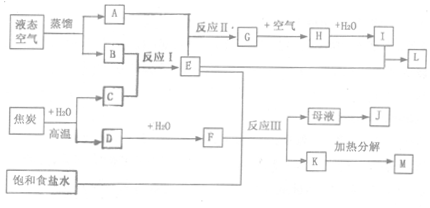
请回答下列问题:
(1)写出上述流程中所涉及的化学工业名称 。
(2)反应I需在500℃进行,其主要原因是 ;H转化为I的过程中,需不断补充空气,其原因是
(3)写出反应Ⅲ的化学方程式
工业上,采用向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通氨气的作用
a.增大NH4+的浓度,使J更多地析出
b.使K更多的析出
c.使K转化为M,提高析出的J的纯度
查看习题详情和答案>>(2012?武汉模拟)某同学欲探究Na2S2O3的有关化学性质,设计如下实验流程图.

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
(2)写出生成白色沉淀W所涉及的离子方程式:
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
①V=
②探究浓度对化学反应速率的影响,应选择
③为了准确控制反应的温度,应采用的加热方式为
查看习题详情和答案>>

请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是:
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
取一小段pH试纸于表面皿上,用洁净的玻璃棒蘸取待测溶液点在pH试纸中段,与比色卡对照,读出溶液的pH.
(2)写出生成白色沉淀W所涉及的离子方程式:
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
(3)将上述流程中所加BaCl2溶液和氯水的顺序颠倒,也得到白色沉淀,能否说明该白色沉淀与 W 为同种物质
否
否
(填“能”、“否”);(4)取三支大小相同的试管,通过侧定Na2S2O3溶液与稀硫酸反应出现浑浊的时间,研究外界条件对化学反应速率的影响.设计实验表格如下:
| 实验 序号 |
实验 温度/℃ |
0.1mol/LNa2S2O3溶液的体积/mL | H2O的 体积/mL |
0.1mol/LH2SO4溶液的体积/mL | 所需 时间/s |
| 甲 | 25 | 5 | 5 | 2 | / |
| 乙 | 25 | 5 | 6 | 1 | / |
| 丙 | 35 | 5 | 5 | V | / |
2
2
;②探究浓度对化学反应速率的影响,应选择
甲、乙
甲、乙
(填实验编号)组实验进行对比分析;③为了准确控制反应的温度,应采用的加热方式为
水浴加热
水浴加热
.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离.相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式.试剂X:
(2)上述实验流程中加入过量的Na2CO3的目的是
(3)按此实验方案得到的溶液3中肯定含有
(4)写出实验流程①②所涉及的离子方程式.
①
查看习题详情和答案>>

请回答下列问题:
(1)写出实验流程中下列物质的化学式.试剂X:
BaCl2或Ba(NO3)2
BaCl2或Ba(NO3)2
,沉淀A:BaSO4
BaSO4
,试剂Y:AgNO3
AgNO3
,沉淀B:AgCl
AgCl
.(2)上述实验流程中加入过量的Na2CO3的目的是
使溶液中的Ag+、Ba2+完全沉淀
使溶液中的Ag+、Ba2+完全沉淀
.(3)按此实验方案得到的溶液3中肯定含有
Na2CO3
Na2CO3
(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的稀HNO3
稀HNO3
,之后若要获得固体NaNO3需进行的实验操作是蒸发
蒸发
(填操作名称).(4)写出实验流程①②所涉及的离子方程式.
①
Ba2++SO42-=BaSO4↓
Ba2++SO42-=BaSO4↓
;②Cl-+Ag+=AgCl↓
Cl-+Ag+=AgCl↓
.我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
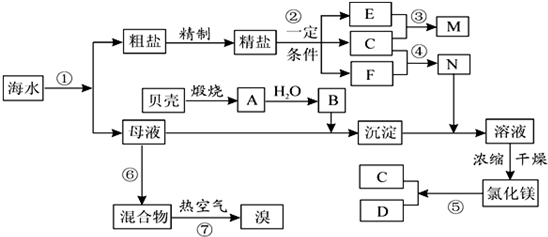
请根据以上信息回答下列问题:
I(1)写出N的化学式和B的名称:N
(2)写出反应②的化学方程式
(3)写出反应③的离子方程式:
Ⅱ粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为
A.②③④①B.③④②①C.④③②①D.③②④①
Ⅲ提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2.
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是
A.分解反应B.化合反应C.置换反应 D.复分解反应
(2)氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体.但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩.试用化学反应方程式解释不选用氮气的原因:
(3)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是
A.从外地购买B.在当地新建生产厂
C.从本厂生产烧碱处循环D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有
(4)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?
查看习题详情和答案>>

请根据以上信息回答下列问题:
I(1)写出N的化学式和B的名称:N
HCl
HCl
、B石灰乳
石灰乳
.(2)写出反应②的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
(3)写出反应③的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
,Ⅱ粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为
AD
AD
.A.②③④①B.③④②①C.④③②①D.③②④①
Ⅲ提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2.
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是
C
C
.A.分解反应B.化合反应C.置换反应 D.复分解反应
(2)氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体.但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩.试用化学反应方程式解释不选用氮气的原因:
3Mg+N2
Mg3N2
| ||
3Mg+N2
Mg3N2
.
| ||
(3)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是
CD
CD
.A.从外地购买B.在当地新建生产厂
C.从本厂生产烧碱处循环D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有
挥发
挥发
性.(4)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?
乙
乙
(填“甲”或“乙”),理由是若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2
若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2
.