摘要:将amol H2S和1mol O2置于一个容积可变的容器内进行反应.维持容器内气体的压强不变.在120℃下测得反应前后容器内气体的密度分别为d1和d2.若a的取值不同.则H2S的氧化产物可能有如下三种情况:(1)全部是SO2此时a的取值范围是 .(2)全部是S.此时a的取值范围是 .并且d1 d2(填“小于 .“大于 或“等于 ).(3)部分是SO2.部分是S.此时a的取值范围是 .反应所生成SO2的物质的量为 mol.容器内气体的物质的量之和为 mol. 第八章 氧族元素 硫酸工业第二课时 硫 硫酸[考纲要求]
网址:http://m.1010jiajiao.com/timu_id_398972[举报]
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
某温度下,将2mol SO2和1mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看习题详情和答案>>
500℃、20Mpa时,将3mol H2和1mol N2置于一容积为2L的密闭容器中发生反应,则反应达到平衡时,平衡常数表达式K=
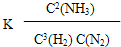 ,此时,增加N2的量,平衡常数将
,此时,增加N2的量,平衡常数将
查看习题详情和答案>>
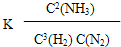
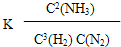
不变
不变
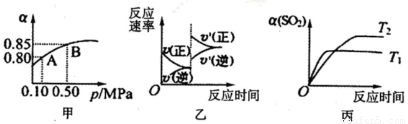
(填“增大”“减小”或“不变”)已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )

查看习题详情和答案>>