网址:http://m.1010jiajiao.com/timu_id_383687[举报]
一、选择题(本题包括
1.D 2.C 3.C 4.D 5.C 6.C 7.D 8.D 9.C l0.C
l1.B 12.C 13.C 14.C 15.D 16.C l 7.B l 8.D 19.B 20.A
二、本题包括1小题,共12分。
21.(12分)
(1)B中装无水硫酸铜,检验水蒸气;C中装澄清的石灰水,检验二氧化碳;(每空1分)
(2)验纯后点燃E处的气体,火焰呈蓝色。(2分,不答“验纯”扣1分)
(3)点燃前应验纯;CO有毒,实验要通风;加热时要均匀受热等。(2分)
(4)挥发出来的草酸蒸气与石灰水反应生成了草酸钙沉淀,会干扰CO2的检验(2分)
在装置B和C装置间增加一个装有水(或烧碱溶液)的洗气装置(2分)
三、本题包括3小题,共38分。
22.(每空2分,共12分)
(2)>
(3)A1 +3NH3?H2O=Al(OH)3↓ +3NH
+3NH3?H2O=Al(OH)3↓ +3NH
(4)NH4Al(SO4)2
(5)336
23.(每空2分,共l 2分)
(1)A:Si B:Mg
(2)抑制氯化镁水解
(3)①Si+2NaOH+H2O=Na2SiO3+2H2↑
③ Mg2Si+4HCl=SiH4↑+2MgCl2
24.(每空2分,共14分)
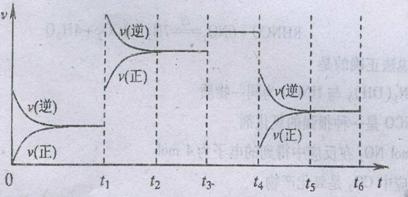
(1)
(2)O2+2CO2+4e =2CO
=2CO
(3)CO2 负极反应产物
②
③ 560
四、本题包括l小题,共l0分。
25.(1)Fe+H2SO4=FeSO4+H2↑(2分)
FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2?6H2O(2分)
(2)解:设生成(NH4)2Fe(SO4)2?6H2O的物质的量为x mol。由上述方程式知:
H2SO4~FeSO4~(NH4)2Fe(SO4)2?6H2 O
1 mol l mol
15×3×10 mol x
mol
mol x
mol
x=0.045
生成(NH4)2Fe(SO4)2?6H2O的质量为:0.045 mol×
(3)① 5、1、8、1、5、4 H2O(2分)
② 83.33%。(2分)
 CH3OH(g)+
CH3OH(g)+H2O(g),该反应的能量变化如图所示

(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=__________

a.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
b.容器内压强保持不变
c.H2的消耗速率与CH3OH的消耗速率之比为3:1
d.容器内的密度保持不变
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是_______ (填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3mol H2
d.选择高效的催化剂
(1)目前工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
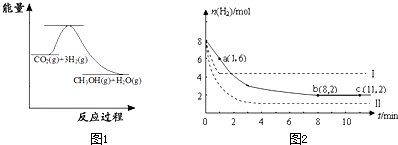
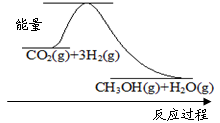
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.该反应是
(2)某温度下,若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2实线所示(图中字母后的数字表示对应的坐标).
①在反应进行的0~1min内,该反应的平均速率v(H2)=
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动.若上述反应体系不改变反应物的物质的量,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是
(3)下列各项中,不能够说明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO2,同时生成1mol CH3OH.
、随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。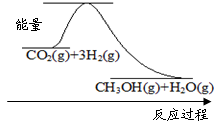
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示(图中字母后的数字表示对应的坐标)。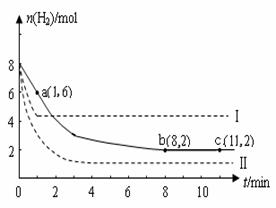
①在反应进行的0~1min内,该反应的平均速率v(H2)= 。
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),反应将向着能够减弱这种改变的方向进行(如增大H2的浓度,反应向右进行以减弱外界条件增大H2的浓度的影响)直至达到新的平衡。若上述反应体系不改变反应物的物质的量,仅分别改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线Ⅱ改变的实验条件是 。
(3)下列各项中,不能够说明CO2(g)+3H2(g)  CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
| A.恒温、恒容条件下,容器内的压强不发生变化 |
| B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等 |
| C.一定条件下,H2O(g)的浓度保持不变 |
| D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH |
(1)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示(图中字母后的数字表示对应的坐标)。
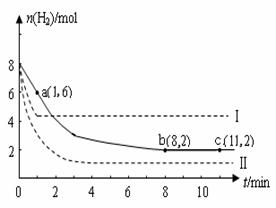
①在反应进行的0~1min内,该反应的平均速率v(H2)= 。
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),反应将向着能够减弱这种改变的方向进行(如增大H2的浓度,反应向右进行以减弱外界条件增大H2的浓度的影响)直至达到新的平衡。若上述反应体系不改变反应物的物质的量,仅分别改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是 ,曲线Ⅱ改变的实验条件是 。
(3)下列各项中,不能够说明CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)已达到平衡的是 (单选)。
CH3OH(g)+H2O(g)已达到平衡的是 (单选)。| A.恒温、恒容条件下,容器内的压强不发生变化 |
| B.一定条件下,CH3OH消耗的速率和CH3OH生成的速率相等 |
| C.一定条件下,H2O(g)的浓度保持不变 |
| D.一定条件下,单位时间内消耗1 mol CO2,同时生成1 mol CH3OH |