网址:http://m.1010jiajiao.com/timu_id_361743[举报]
2009.5
一、选择题(每小题1分,共25分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
D
B
A
B
A
D
B
B
D
A
C
C
C
D
D
题号
16
17
18
19
20
21
22
23
24
25
答案
D
C
D
C
A
C
C
D
A
D
说明:以下各题若有其他正确答案,均可得分。
二、填空题(除29题(1)小题2分外,每空1分,共29分)
26.(6分)
(1)①糖类、油脂、蛋白质;②锌。 (2)①钙,②A。 (3)①0.4,②1.1。
27.(7分)
(1)A。 (2)①蒸馏。②乳化。(3)①甲。②b, ③升温(或增加溶剂)。④不变。
 28.(7分)
28.(7分)
 (1)A。
(2)①混合物。 ②生铁的含碳量比钢高。 ③3CO + Fe2O3 3CO2 + 2Fe 。
(1)A。
(2)①混合物。 ②生铁的含碳量比钢高。 ③3CO + Fe2O3 3CO2 + 2Fe 。
(3)FeCl2 + H2 Fe + 2HCl (4)①Fe + CuCl2 = FeCl2 + Cu ;②Fe 、Cu。
29.(4分)
(1)B、C、D、E。(全部选对得2分,少选1个且无错误选项得1分)
(2)Na+、Cl-、H2O。
(3)⑤④①②③。
 30.(5分)
30.(5分)
(1)①O2; ②2H2O 2H2↑+ O2↑; ③Ca(OH)2+ CO2= CaCO3↓+ H2O
(2)①置换反应, ②Fe + H2SO4= FeSO4 + H2↑。
三、实验题(每空1分,共19分)
 31.(6分)
31.(6分)
(1)①2KMnO4 K2MnO4 + MnO2 + O2↑,②A。 ③将带火星的木条置于集气瓶口,若木条复燃,则氧气已满。
(2)①B、C, ②能, ③氧气和二氧化碳均可以由固体和液体药品在常温条件下反应制得,且它们的密度均大于空气。
32.(7分)
(1)①稀盐酸 ②Na2CO3 ③滴加步骤2检验出的溶液。 ④一支试管溶液中有白色沉淀生成,则原溶液是Ca(OH)2溶液;另一支试管无明显现象,则原溶液是NaOH溶液。⑤ Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(2)①小伟, ②Ca(OH)2。
33.(6分)
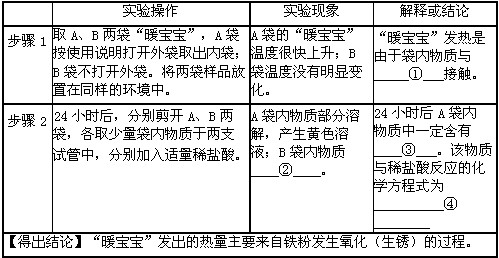
①氧气 ②部分溶解,产生无色气泡,(溶液为浅绿色)。 ③氧化铁。
④Fe2O3+ 6HCl = 2FeCl3 + 3H2O
⑤取适量A袋内物质于烧杯内,加入过量稀盐酸,充分反应后过滤,洗涤、烘干滤渣。点燃滤渣,将产生的气体通入澄清石灰水,若产生能使澄清石灰水变浑浊的气体,则剩余物质中还含有活性炭。[答案合理即给分]
⑥保存“暖宝宝”取暖贴时不要使外袋破损,保持包装的气密性,以防失效。
四、计算题(共7分)
34.(3分)
 [解]设:需要O2的质量为x。
[解]设:需要O2的质量为x。
2H2+ O2 2H2O ……………………………………(1分)
 4 32
4 32

 ×100% = 93.3%
×100% = 93.3%
 x = 0.
x = 0.