摘要:A.生物能 B.化学能 C.热能 D.电能
网址:http://m.1010jiajiao.com/timu_id_356203[举报]
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
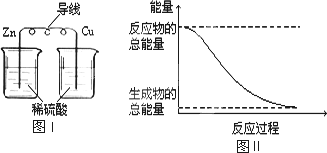
- A.化学反应中能量变化的主要原因是化学键的断裂与生成
- B.铝热反应中, 反应物的总能量比生成物的总能量低
- C.图I所示的装置能将化学能转变为电能
- D.图II所示的反应为吸热反应
|
化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是
| |
| [ ] | |
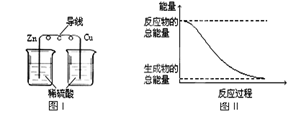
A. |
化学反应中能量变化的主要原因是化学键的断裂与生成 |
B. |
铝热反应中,反应物的总能量比生成物的总能量低 |
C. |
图Ⅰ所示的装置能将化学能转变为电能 |
D. |
图Ⅱ所示的反应为吸热反应 |
化学变化中既有物质变化,也有能量变化,研究化学反应有利于指导工业生产.下列是常见的化学反应:①电解熔融氯化钠 ②氮气与氢气合成氨气 ③锌与稀硫酸反应 ④煅烧石灰石.
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
查看习题详情和答案>>
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
②③
②③
(填序号,下同);从有无电子转移角度看上述反应属于非氧化还原反应的是④
④
;从反应前后物质种类的变化角度看,①和④均属于分解
分解
反应;①和②在变化过程中断裂的化学键类型分别为离子键
离子键
、共价键
共价键
.(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
c
c
.a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
锌
锌
,电子流向正
正
极.(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
增大
增大
(填“增大”、“减小”或“不变”,下同),逆反应速率增大
增大
;请列举一项该反应达到平衡的标志正反应速率等于逆反应速率
正反应速率等于逆反应速率
.化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.图中所列装置是用燃烧法确定有机物分子式常用的装置.(每一组仪器只能使用一次)

回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是
(2)C装置中浓硫酸的作用是
(3)D装置中MnO2的作用是
(4)若准确称取7.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22g,B管质量增加10.8g,则该有机物的最简式为
(5)要确定该有机物的分子式,则
 .
.
查看习题详情和答案>>

回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是
g→f,e→h,i→c,d→a
g→f,e→h,i→c,d→a
.(2)C装置中浓硫酸的作用是
吸收水分,得到干燥纯净的O2
吸收水分,得到干燥纯净的O2
.(3)D装置中MnO2的作用是
作催化剂,加快产生O2的速率
作催化剂,加快产生O2的速率
.(4)若准确称取7.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22g,B管质量增加10.8g,则该有机物的最简式为
C5H12
C5H12
.(5)要确定该有机物的分子式,则
不
不
(填“是”或“不”)需要测定其他数据,若能确定其分子式,若其一氯代物只有一种,则其结构简式为