摘要:5H2(g)+0.5 Cl2,△H= Q2
网址:http://m.1010jiajiao.com/timu_id_3208054[举报]
由游离态的氮转变为化合态的氮的过程称为氮的固定。合成氨工业是非常重要的人工固氮途径,其生产示意图如图所示。若在温度、容积相同的3个密闭容器中,按甲、乙、丙不同方式投入反应物,保持恒 温、恒容(1 L),测得反应达到平衡时的有关数据如下
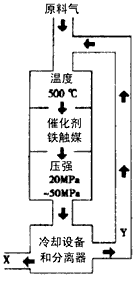

请回答下列问题。
(1) 2c1____c3(填“大于”、“小于”或“等于”)。
(2)下列措施中,_______(填选项)可以提高原料的利用率。
A.使用催化剂
B.将生成的NH3及时分离出反应体系
C.将尾气中的N2、H2回收再利用
(3)达到平衡状态时,甲中的平衡常数K=__________(填表达式),若温度不变,再加入1.5 mol H2后重新达到平衡,则N2的平衡浓度_______(填“增大”、“不变”或“减 小”),H2的转化率______(填“升高”、“降低”或“不 变”),NH3的体积分数____(填“增大”、“不变”或“减 小”)。
(4)已知:
0.5N2(g) +1.5H2(g)=N +3H △H1
NH3(l) =NH3(g) △H2
NH3(g)=N +3H △H3
则N2(g)+3H2(g)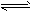 2NH3(l) △H =________,该热化学反应方程式的意义是_______________。
2NH3(l) △H =________,该热化学反应方程式的意义是_______________。
查看习题详情和答案>>
(1) 2c1____c3(填“大于”、“小于”或“等于”)。
(2)下列措施中,_______(填选项)可以提高原料的利用率。
A.使用催化剂
B.将生成的NH3及时分离出反应体系
C.将尾气中的N2、H2回收再利用
(3)达到平衡状态时,甲中的平衡常数K=__________(填表达式),若温度不变,再加入1.5 mol H2后重新达到平衡,则N2的平衡浓度_______(填“增大”、“不变”或“减 小”),H2的转化率______(填“升高”、“降低”或“不 变”),NH3的体积分数____(填“增大”、“不变”或“减 小”)。
(4)已知:
0.5N2(g) +1.5H2(g)=N +3H △H1
NH3(l) =NH3(g) △H2
NH3(g)=N +3H △H3
则N2(g)+3H2(g)
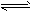 2NH3(l) △H =________,该热化学反应方程式的意义是_______________。
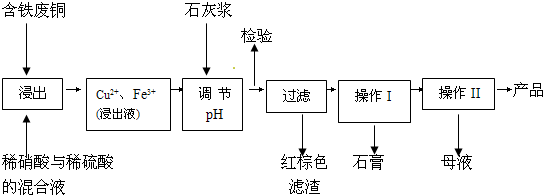
2NH3(l) △H =________,该热化学反应方程式的意义是_______________。 硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4?5H2 O)和副产物石膏(CaSO4?2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的离子方程式
(3)操作I包括蒸发浓缩、
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是
②指出你认为不合理方案存在的问题是
查看习题详情和答案>>

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
Fe(OH)3
Fe(OH)3
;(2)写出浸出过程中生成硫酸铜的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
;(3)操作I包括蒸发浓缩、
趁热过滤
趁热过滤
等操作,温度应该控制在100
100
℃左右;(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为
冷却结晶
冷却结晶
、过滤
过滤
、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是减少因晶体溶解而造成的损失
减少因晶体溶解而造成的损失
;干燥时采用晾干,不用加热烘干的原因是避免加热过程中晶体受热分解
避免加热过程中晶体受热分解
.(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是
方案二
方案二
;②指出你认为不合理方案存在的问题是
Cu2+的蓝色对检验有干扰
Cu2+的蓝色对检验有干扰
.0.5mol氢气和0.5mol碘晶体完全反应,生成1mol碘化氢气体,吸收26.5 kJ 的热,则下列热化学方程式正确的是 ( )
A.H2(g) + I2(s)  2HI(g) - 26.5kJ 2HI(g) - 26.5kJ |
B.H2 + I2 2HI - 53kJ 2HI - 53kJ |
C.H2(g) + I2(s)  2HI(g) - 53kJ 2HI(g) - 53kJ |
D.0.5H2 + 0.5I2  HI - 26.5kJ HI - 26.5kJ |
(11分)硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图: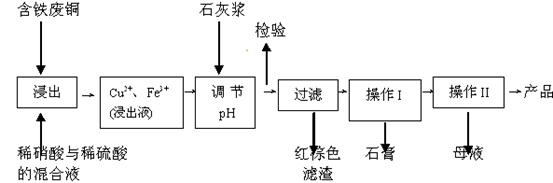
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
温度(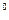 C) C) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32[来源:Z|xx|k.Com] | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8[来源:学*科*网] | 114 |
(1)红棕色滤渣的主要成分是 ;
(2)写出浸出过程中生成硫酸铜的离子方程式 ;
(3)操作I包括蒸发浓缩、 等操作,温度应该控制在
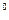 C左右;
C左右;(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为 、 、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是 ;干燥时采用晾干,不用加热烘干的原因是 。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是 ;
②指出你认为不合理方案存在的问题是 。 查看习题详情和答案>>
 2HI(g) - 26.5kJ
2HI(g) - 26.5kJ