摘要: 漂白粉在空气中变质 / 在工业上应用 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO Ca(ClO)2+2HCl==CaCl2+2HClO
网址:http://m.1010jiajiao.com/timu_id_3207382[举报]
Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接
(2)圆底烧瓶中发生反应的化学方程式是
(3)E装置的作用是
(4)装置
查看习题详情和答案>>
X
X
(填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
| ||
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接
i
i
,j
j
接g
g
,f
f
接e
e
,d
d
接b
b
,c
c
接h
h
.(2)圆底烧瓶中发生反应的化学方程式是
MnO2+4Hl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4Hl(浓)
MnCl2+Cl2↑+2H2O
.如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为
| ||
反应一段时间后,盐酸浓度变稀,不能和二氧化锰就反应
反应一段时间后,盐酸浓度变稀,不能和二氧化锰就反应
.(3)E装置的作用是
除去多余的氯气,防止污染空气
除去多余的氯气,防止污染空气
,F装置的作用是除去氯气中的氯化氢
除去氯气中的氯化氢
.(4)装置
B
B
(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是次氯酸
次氯酸
.Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后______ (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式______.再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式______.
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.
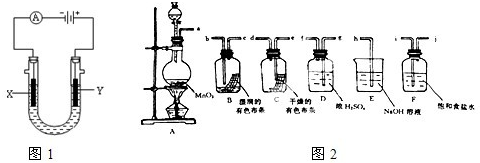
(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接______,______接______,______接______,______接______,______接______.
(2)圆底烧瓶中发生反应的化学方程式是______.如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为______.
(3)E装置的作用是______,F装置的作用是______.
(4)装置______(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是______.
查看习题详情和答案>>
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接______,______接______,______接______,______接______,______接______.
(2)圆底烧瓶中发生反应的化学方程式是______.如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为______.
(3)E装置的作用是______,F装置的作用是______.
(4)装置______(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是______.
Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后 (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式 .再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式 .
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接 , 接 , 接 , 接 , 接 .
(2)圆底烧瓶中发生反应的化学方程式是 .如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为 .
(3)E装置的作用是 ,F装置的作用是 .
(4)装置 (填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是 . 查看习题详情和答案>>
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性.

(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接 , 接 , 接 , 接 , 接 .
(2)圆底烧瓶中发生反应的化学方程式是 .如果将过量二氧化锰与20mL 12mol?L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为 .
(3)E装置的作用是 ,F装置的作用是 .
(4)装置 (填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是 . 查看习题详情和答案>>
某化学小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 __ ,漂白粉在空气中变质的原因 (用化学反应方程式说明)
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
(1)氯水在和下列物质反应时,分别是氯水中哪种微粒在起主要作用?(写出其化学式)
①氯水与硝酸银溶液反应产生白色沉淀
②氯水中刚滴入石蕊试液时显红色
③氯水中加入碳酸钠产生无色气体
④氯化能使无水硫酸铜变蓝
⑤氯水中加镁粉,氯水的黄绿色会褪去
(2)氯水经光照后,pH值减小,该反应的化学方程式是
(3)在分别盛有NaCl溶液和NaI溶液的A、B两支试管中各加入1mL溴的CCl4溶液,用力振荡后再静止片刻.在A试管中出现的现象是
(4)工业上生产漂白粉的化学反应方程式为:
查看习题详情和答案>>
①氯水与硝酸银溶液反应产生白色沉淀
Cl-
Cl-
;②氯水中刚滴入石蕊试液时显红色
H+
H+
,过一段时间后,试液褪色HClO
HClO
;③氯水中加入碳酸钠产生无色气体
H+
H+
;④氯化能使无水硫酸铜变蓝
H2O
H2O
;⑤氯水中加镁粉,氯水的黄绿色会褪去
Cl2
Cl2
.(2)氯水经光照后,pH值减小,该反应的化学方程式是
2HClO
2HCl+O2↑
| ||
2HClO
2HCl+O2↑
.
| ||
(3)在分别盛有NaCl溶液和NaI溶液的A、B两支试管中各加入1mL溴的CCl4溶液,用力振荡后再静止片刻.在A试管中出现的现象是
下
下
层为CCl4层(填上或下),CCl4层呈棕红
棕红
色,B试管中的CCl4层呈紫
紫
色.试写出上述实验中可能发生的离子方程式Br2+2I -=2Br -+I2
Br2+2I -=2Br -+I2
.(4)工业上生产漂白粉的化学反应方程式为:
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
.漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
,用化学方程式表示漂白粉在空气中漂白的原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.