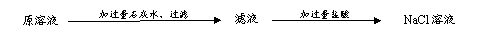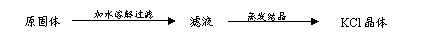网址:http://m.1010jiajiao.com/timu_id_320514[举报]
一、选择题(本题包括15小题,每小题2分,共30分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
A
C
A
C
D
B
C
B
D
B
D
C
B
A
C
二、选择题(本题共5小题,每小题2分,共10分)若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分。
题号
16
17
18
19
20
答案
B
C
AC
CD
BC
三、(本题共7小题,每空1分,共31分)
21.E C B A
22.(1)蛋白质 锌 (2)不要高温加热 食醋
(3)甲醛(一氧化碳、黄曲霉毒素等)
23.(1)⑤④①②③
(2)3┱1 化合
24.(1)B (2)Na + Na2O (3)MgS
(4)原子的电子层数等于周期数(其他合理答案也给分)
|


 ,CaCO3的质量:35g-15g=20g。样品中钙元素、碳元素和氧元素的质量比:
,CaCO3的质量:35g-15g=20g。样品中钙元素、碳元素和氧元素的质量比:
 2
Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为
,蘸有浓NaOH 溶液的棉花的作用是
。
2
Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为
,蘸有浓NaOH 溶液的棉花的作用是
。
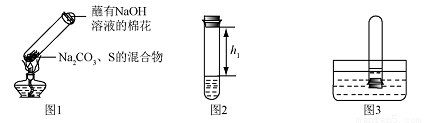
 步骤2:取适量滤液于试管中,滴加稀硫酸。
步骤2:取适量滤液于试管中,滴加稀硫酸。 A.由氧化铁制取氢氧化铁:
A.由氧化铁制取氢氧化铁:
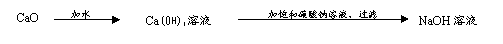
 B.由氧化钙制取氢氧化钠溶液
B.由氧化钙制取氢氧化钠溶液