网址:http://m.1010jiajiao.com/timu_id_307671[举报]
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷。
第Ⅰ卷共18小题,每题6分.共108分。
一、选择题:选对的给6分,选错的或未选得给0分。
1.C 2.B 3.B 4.A 5.A 6.D 7.C 8.B 9.C 10.D 11.B 12.C
二、选择题:全部选对的给6分,选对但不全的给3分,有选错得或未选的给0分。
13.C 14.A、D 15.D 16.B 17.A、D 18.D

第Ⅱ卷必考部分共9题,共157分。
19.(18分)
(1)1.996~1.998 (2分) 1.094(2分)
(2)保护电源,防止短路(2分)
(3)如右图所示(有一处错就不给分)(4分)
(4)2.9;1.0(4分)
(5)多测几组R、U,分别求出电动势E、内阻r,再求E、r的平均值(2分);
或利用U-I图象处理数据。(2分)
20.(15分)
解:(1)解除锁定弹开物块AB后,两物体的速度大小
 ①(2分)
①(2分)
弹簧储存的弹性势能 ②(3分)
②(3分)
(2)物块B滑上传送带匀减速运动,当速度减为零时,滑动的距离最远.
由动能定理得: ③(2分)
③(2分)
得: ④(2分)
④(2分)
(3)物块B沿传送带向左返回时,先匀加速运动,物块速度与传送带速度相同时再一起匀速运动,设物块B加速到传送带速度v需要滑动的距离为
由 得
得
 ⑤(3分)
⑤(3分)
表明物块B滑回水平面MN的速度没有达到传送带的速度
所以:  ⑥(3分)
⑥(3分)
21.(19分)
解:(1)输电线冰层的体积V冰 = πR
由对称关系可知,塔尖所受压力的增加值等于一根导线上冰层的重力,即
 Δm = ρV冰 g= πρR2Lg (2分)
Δm = ρV冰 g= πρR2Lg (2分)
(画出受力图示正确给4分)
(2)输电线与冰层的总质量M' = m
输电线受力如图甲所示。
由共点力的平衡条件,得
输电线在最高点所受的拉力 (2分)
(2分)
半根输电线的受力如图乙所示。
由共点力的平衡条件,得F2 = F1sinθ (3分)
输电线在最低点所受的拉力 (2分)
(2分)
22.(20分)
解:(1)电场力与洛伦兹力平衡得:qE=qv0B得:E=v0B 方向竖直向上 (2分)
(2)根据运动的对称性,微粒能从P点到达Q点,应满足 (2分)
(2分)
其中x为每次偏转圆弧对应的弦长,偏转圆弧对应的圆心角为 或
或 . (2分)
. (2分)
设圆弧的半径为R,则有2R2=x2,可得: (2分)
(2分)
又 由①②③式得:
由①②③式得: ,n=1、2、3、……
(2分)
,n=1、2、3、……
(2分)
(3)当n取奇数时,微粒从P到Q过程中圆心角的总和为
 ,(2分)
,(2分) ,其中n=1、3、5、…(2分)
,其中n=1、3、5、…(2分)
当n取偶数时,微粒从P到Q过程中圆心角的总和为:
 ,(2分)
,(2分) ,其中n=2、4、6、……(2分)
,其中n=2、4、6、……(2分)
 欲使时间最小,取n=1或者2,此时
欲使时间最小,取n=1或者2,此时 (2分)
(2分)
23.(15分)
 解:(1)H (1分)
(2) (1分)
解:(1)H (1分)
(2) (1分)
(3)3Cu + 2NO3- + 8H+ === 3Cu2+ + 2NO↑ + 4H2O(3分)
 (4)① NH4+ + OH- H2O +
NH3 ↑ (2分)
(4)① NH4+ + OH- H2O +
NH3 ↑ (2分)
② SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ (3分)
(5)① (NH4)2Fe(SO4)2?6H2O (2分)
② 5Fe2+ + MnO4- + 8H+ = 5Fe3++ Mn2+ + 4H2O (3分)
24.(15分)
解:⑴2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O(2分)
|
 (2分);
(2分); 立毛肌(1分)
立毛肌(1分) (2分)
(2分)




 酯化反应(或取代反应)
酯化反应(或取代反应) 2NO2(g) △H>0,在密闭容器中达到平衡。下列说法不正( )
2NO2(g) △H>0,在密闭容器中达到平衡。下列说法不正( ) 
 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )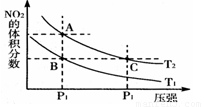

 2CO(g)平衡常数K1;
2CO(g)平衡常数K1; 
