摘要:25℃时.K=1.71×l022(1)写出反应①的平衡常数表达式 K= .
网址:http://m.1010jiajiao.com/timu_id_284011[举报]


(2009?肇庆二模)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4H2(g)
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=
.
(2)条件相同时,反应①与反应②相比,转化程度更大的是
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
①温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:
查看习题详情和答案>>
①2CO2(g)+6H2(g)
| 催化剂 |
②2CO(g)+4H2(g)
| 催化剂 |
(1)写出反应①的平衡常数表达式K=
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
(2)条件相同时,反应①与反应②相比,转化程度更大的是
②
②
;以CO2为原料合成乙醇的优点是废弃物利用,有利于环保
废弃物利用,有利于环保
(写出一条即可).(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
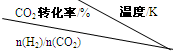 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”、或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值
不变
不变
(填“增大”、“减小”、或“不变”),对生成乙醇有利
有利
(填“有利”或“不利”).(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ
.(2010?金平区模拟)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=
.
(2)条件相同时,反应①与反应②相比,转化程度更大的是
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
①温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(4)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:
查看习题详情和答案>>
①2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011②2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022(1)写出反应①的平衡常数表达式K=
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
(2)条件相同时,反应①与反应②相比,转化程度更大的是
②
②
;以CO2为原料合成乙醇的优点是废弃物利用,有利于环保
废弃物利用,有利于环保
(写出一条即可).(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
| 温度/Kn(H2)/n(CO2)CO2转化率/% | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”、或“不变”).②提高氢碳比[n(H2)/n(CO2)],K值
不变
不变
(填“增大”、“减小”、或“不变”),对生成乙醇有利
有利
(填“有利”或“不利”).(4)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:
2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ/mol
2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ/mol
.与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)N的电极反应式为
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=
 ,
,
②条件相同时,反应I与反应II相比,转化程度更大的是
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值
查看习题详情和答案>>

(1)N的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
1.12
1.12
L(标准状况下).(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
4.6
4.6
g.(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
| ||
反应II:2CO2(g)+4H2(g)
| ||
①写出反应I的平衡常数表达式K=


②条件相同时,反应I与反应II相比,转化程度更大的是
反应II
反应II
.③在一定压强下,测得反应I的实验数据如下表:
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”或“不变”),提高氢碳比.n(H2)/n(CO2),对生成乙醇有利
有利
(填“不利”或“有利”). 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.①2CO2(g)+6H2(g)
| 催化剂 |
②2CO(g)+4H2(g)
| 催化剂 |
(1)写出反应①的平衡常数表达式K=
(2)条件相同时,反应①与反应②相比,转化程度更大的是
(3)在一定压强下,测得反应①的实验数据如下表.
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
(4)在如图的坐标系中作图说明压强变化对反应①的化学平衡的影响,并标明横坐标、纵坐标的含义.
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。右图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100mL3.00mol/L的CuSO4溶液。请回答下列问题:
(1)N的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气 L(标准状况下)。
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇 g。
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K= ,
②条件相同时,反应I与反应II相比,转化程度更大的是 。
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:
温度升高,K值 (填“增大”、“减小”或“不变”),提高氢碳比。n(H2)/n(CO2),对生成乙醇 (填“不利”或“有利”)。
查看习题详情和答案>>