摘要:(1)MnO2+4H -+2Cl- Mn2++Cl2↑+2H2O (2)① 相同 产生棕黄色的烟 V2O3 △ ② 5Cl2+l2+6H2O=2HlO3+10HCl (3)A C 当加入氨水时.使该溶液变为碱性.产生BaSO3白色沉淀,当加入HNO3时.使溶液中H2SO3氧化成H2SO4.产生BaSO4白色沉淀. (4)S2O23-+Cl2+H2O=SO2-4+S↓2Cl-+2H+
网址:http://m.1010jiajiao.com/timu_id_270099[举报]
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如图1所示的实验装置.
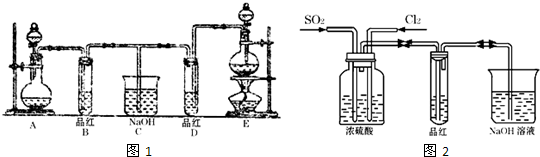
(1)实验室常选用制CO2的发生装置制SO2,实验室用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:
(3)甲乙两名同学分别利用如图2所示装置探究两种气体按不同比例混合后的漂白性.试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:
查看习题详情和答案>>

(1)实验室常选用制CO2的发生装置制SO2,实验室用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中
E
E
装置(填装置序号)制Cl2,通过分液漏斗
分液漏斗
(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应离子方程式为:MnO2+4H++2Cl-
Mn 2++Cl2↑+2H2O
| ||
:MnO2+4H++2Cl-
Mn 2++Cl2↑+2H2O
.
| ||
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:
溶液由无色变成红色
溶液由无色变成红色
,D:溶液没有明显变化
溶液没有明显变化
.(3)甲乙两名同学分别利用如图2所示装置探究两种气体按不同比例混合后的漂白性.试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
使两种气体充分混合,通过观察气泡的速度控制气体流量,使二者按一定比列混合
使两种气体充分混合,通过观察气泡的速度控制气体流量,使二者按一定比列混合
.②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:
SO2和Cl2按1:1进气,二者恰好完全反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O═H2SO4+2HCl
SO2和Cl2按1:1进气,二者恰好完全反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O═H2SO4+2HCl
(结合反应方程式).
取0.04 mol KMnO4固体加热一段时间后,收集到a mol单质气体,此时KMnO4的分解率为x,在反应后的残留固体中加入100 mL 36.5%、密度1.18 g/cm3的浓盐酸(过量)并加热,充分反应后又收集到b mol单质气体(假定气体全部逸,出),锰元素(Mn)全部以Mn2+存在于反应后的溶液中。
分解产物与浓盐酸在加热时涉及下列反应:
①![]() +16H+10Cl-====Mn2++5C12+8H2O
+16H+10Cl-====Mn2++5C12+8H2O
②□![]() +□Cl-+□H+====□Mn2++□Cl2+□H2O
+□Cl-+□H+====□Mn2++□Cl2+□H2O
③MnO2+4H++2Cl-![]() Mn2++Cl2
Mn2++Cl2![]() +2H2O
+2H2O
(1)试配平反应②的离子方程式,将化学计量数填入上述对应的方框内(如果是1,也必须填写)。
(2)a+b=_________(用含x的代数式表示)。
(3)当x=__________时,(a+b)取最小值,且最小值为_________。
(4)当a+b=0.09mol时,0.04mol KMnO4按上述操作反应后,将所得溶液稀释至1 L。该稀释后的溶液中c(H+)=_________mol·L-1。
查看习题详情和答案>>(2009?浙江)单晶硅是信息产业中重要的基础材料.通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式
(2)装置A中g管的作用是
装置E中的h瓶需要冷却的理由是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
查看习题详情和答案>>

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置A中g管的作用是
平衡压强,使液体顺利流出并防止漏气
平衡压强,使液体顺利流出并防止漏气
;装置C中的试剂是浓硫酸
浓硫酸
;装置E中的h瓶需要冷却的理由是
产物SiCl4沸点低,需要冷凝收集
产物SiCl4沸点低,需要冷凝收集
.(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
Al、P、Cl
Al、P、Cl
(填写元素符号).(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
否
否
(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点
KMnO4溶液的紫红色可指示反应终点
.②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
4.480%
4.480%
.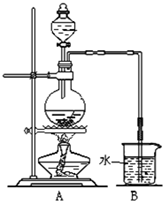 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.(1)请简述如何检查该装置的气密性.
将倒气管插入盛水的烧杯中,用手捂住圆底烧瓶(或用酒精灯微热圆底烧瓶),倒气管口有气泡冒出.冷却后,倒气管中产生水柱,一段时间没有变化,说明气密性良好
将倒气管插入盛水的烧杯中,用手捂住圆底烧瓶(或用酒精灯微热圆底烧瓶),倒气管口有气泡冒出.冷却后,倒气管中产生水柱,一段时间没有变化,说明气密性良好
.(2)写出A装置中发生反应的离子方程式
MnO2+4H++2Cl-
Mn2++C12↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++C12↑+2H2O
.
| ||
(3)新制氯水能使红色布条退色.对于使红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种物质除水外都有可能.请你设计实验探究、验证,得出正确结论.
①提出假设,并进行实验探究、验证,分别简述实验的过程、现象和结论.
假设一:盐酸能使红色布条退色.探究、验证的实验过程、现象和结论为:
用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用
用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用
.假设二:
氯气使红色布条退色
氯气使红色布条退色
.探究、验证的实验过程、现象和结论为:把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用
把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用
.假设三:HClO能使布条退色.本假设的实验探究、验证不做要求.
②得出的结论是
次氯酸使红色布条退色
次氯酸使红色布条退色
.(4)某同学提出该装置需要进一步改进,请你写出改进的措施(或画出必要的装置图)
增加尾气吸收装置(或如图 )
)
 )
)增加尾气吸收装置(或如图 )
)
. )
) 某研究小组制取氯气,并将氯气通入烧碱溶液制备少量消毒液(主要成分是NaClO),设计了下列装置,回答有关问题:
某研究小组制取氯气,并将氯气通入烧碱溶液制备少量消毒液(主要成分是NaClO),设计了下列装置,回答有关问题:(1)仪器A的名称为
分液漏斗
分液漏斗
,B装置中反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2+2H2O
;
| ||
(2)饱和食盐水的作用是
除去氯气中的HCl
除去氯气中的HCl
,能否省去盛有浓硫酸的洗气瓶?能
能
(回答“能”或“不能”),理由是水的存在不影响氯气和NaOH溶液的反应
水的存在不影响氯气和NaOH溶液的反应
;(3)生成消毒液的反应的离子方程式为
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(4)工业上制取氯气的反应的化学方程式为
2NaCl+2H2O
2NaOH+H2+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2+Cl2↑
.
| ||