摘要:(1)0.04mol/L (2)0.025mol/L (3)4.17×10-5
网址:http://m.1010jiajiao.com/timu_id_266165[举报]
Ⅰ将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g) 2C(g)+2D(g),
2C(g)+2D(g),
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为
(2)反应前A的物质的量浓度是
(3)平衡后,生成物D的浓度为
Ⅱ某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2 2SO3反应.几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为
2SO3反应.几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为
查看习题详情和答案>>
3A(g)+B(g)
 2C(g)+2D(g),
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为
0.04mol?L-1?s-1
0.04mol?L-1?s-1
;(2)反应前A的物质的量浓度是
1.5mol?L-1
1.5mol?L-1
;(3)平衡后,生成物D的浓度为
0.4mol?L-1
0.4mol?L-1
;Ⅱ某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2
 2SO3反应.几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为
2SO3反应.几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为33.3%
33.3%
. (2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
(2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.(1)合成二甲醚反应一:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)△H=-247kJ/mol一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
AE
AE
.A.低温高压 B.加催化剂 C.体积不变充入N2 D.增加CO浓度 E.分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)═CH3OCH3(g)+H2O(g).在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物 质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |
400
400
.②10min内平均反应速率v(CH3OH)=
0.04mol?L-1?min-1
0.04mol?L-1?min-1
;(3)如图为绿色电源“二甲醚燃料电池”的工作原理示意图.该反应的还原剂是
二甲醚
二甲醚
(写名称);若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:
(CH3)2O-12e-+3H2O=2CO2+12H+或C2H6O-12e-+3H2O=2CO2+12H+
(CH3)2O-12e-+3H2O=2CO2+12H+或C2H6O-12e-+3H2O=2CO2+12H+
.A、D、E、M、L是原子序数依次增大的五种短周期元素.已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物.回答下列问题:
(1)元素D在元素周期表中的位置是
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为
(3)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为
(4)设化合物甲、乙、丙分别为DA3EA、DA3EDA3、A2E.
ⅰ:已知:(1)丙(g)═丙(l)△H=-Q1 kJ?mol-1
(2)2甲(l)+3E2(g)═2DE2(g)+4丙(g)△H=-Q2 kJ?mol-1
Q1、Q2均大于0.若要使32g液态甲完全燃烧并恢复到室温,放出的热量为
ⅱ:已知:2甲(g)=乙(g)+丙(g).在某温度下,在1L密闭容器中加入甲,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
①该温度下反应的平衡常数为
②10min内平均反应速率v(甲)=
ⅲ:如图是乙为燃料的绿色电源工作原理示意图.若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:

查看习题详情和答案>>
(1)元素D在元素周期表中的位置是
第二周期第IVA族
第二周期第IVA族
.(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为
Cl2+2OH-=ClO-+Cl-+H2O
Cl2+2OH-=ClO-+Cl-+H2O
.(3)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为
NaClO>NaHCO3>NaOH
NaClO>NaHCO3>NaOH
.(填化学式)(4)设化合物甲、乙、丙分别为DA3EA、DA3EDA3、A2E.
ⅰ:已知:(1)丙(g)═丙(l)△H=-Q1 kJ?mol-1
(2)2甲(l)+3E2(g)═2DE2(g)+4丙(g)△H=-Q2 kJ?mol-1
Q1、Q2均大于0.若要使32g液态甲完全燃烧并恢复到室温,放出的热量为
(2Q1+0.5Q2)kJ
(2Q1+0.5Q2)kJ
.ⅱ:已知:2甲(g)=乙(g)+丙(g).在某温度下,在1L密闭容器中加入甲,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |
400
400
.②10min内平均反应速率v(甲)=
0.04mol?L-1?min-1
0.04mol?L-1?min-1
.ⅲ:如图是乙为燃料的绿色电源工作原理示意图.若b电极的反应式为:3O2+12e-+12H+═6H2O,则a电极的反应式为:
(CH3)2O-12e-+3H2O=2CO2+12H+
(CH3)2O-12e-+3H2O=2CO2+12H+
.
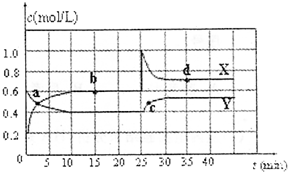 (2009?长春一模)可知NO2和N2O4可以相互转化:2NO2(g)
(2009?长春一模)可知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.回答下列问题:
N2O4(g);△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.回答下列问题: