网址:http://m.1010jiajiao.com/timu_id_260004[举报]
一、单项选择题(45分)
1.D 2.B 3.A 4.C 5.B 6.B 7.C 8.A 9.D 10.B 11.C 12.B 13.D 14.D 15.A
二、(27分
16.(6分)(1)0.05mol?L-1?s-1 (2分)
(2)0.05mol(2分) (3).files/image291.gif) (2分)
(2分)
17.(9分)(1)碱(1分).files/image293.gif) (2分
(2分
(2).files/image295.gif) (2分,只写离子符号不得分)
(2分,只写离子符号不得分)
(3)④ ⑤ ③ ② ①(2分)
(4)NAOH完全电离(1分),.files/image030.gif) 水解是可逆反应,反应进行不彻底(1分)
水解是可逆反应,反应进行不彻底(1分)
18.(12分)(1).files/image298.gif)
.files/image300.gif)
.files/image112.gif)
.files/image303.gif) (各1分,写物质名称也可给分)
(各1分,写物质名称也可给分)
(2).files/image305.gif) =====
=====.files/image307.gif) (3分)
(3分)
.files/image309.gif) =====
=====.files/image311.gif) (3分)
(3分)
(3) .files/image313.gif)
.files/image108.gif) (2分,各1分)
(2分,各1分)
三、(22分)19.(11分)(1).files/image316.gif)
.files/image318.gif)
.files/image320.gif) (2分)
(2分)
.files/image322.gif)
.files/image261.gif) (2分,各1分)红棕色褪去(1分) 加成(1分)
(2分,各1分)红棕色褪去(1分) 加成(1分)
(2)分液漏斗(1分).files/image325.gif) (2分)
(2分)
(3).files/image326.gif) (2分)
(2分)
20.(11分)(1)铁丝在氯气中燃烧,生成棕黄色的烟(3分)
黄(2分) 抑制.files/image328.gif) 水解(3分),答防止
水解(3分),答防止.files/image328.gif) 水解扣1分)
水解扣1分)
(2).files/image330.gif) =====
=====.files/image332.gif) (3分)
(3分)
四、(6分)21.(6分)0.75mol?L-1或0.95 mol?L-1(各3分)
B卷
五、(16分)
22.C 23.D 24.D 25.B 26.C 27.A 28.D 29.B
六、(28分)30.(4分)(1).files/image334.gif) +
+ .files/image336.gif) =====
===== .files/image338.gif) (2分)
(2分)
(2).files/image340.gif) =====
===== .files/image342.gif) (2分)
(2分)
31.(8分)(1).files/image344.gif)
.files/image346.gif)
.files/image046.gif) (3分,各1分,有错扣1分)
(3分,各1分,有错扣1分)
.files/image349.gif) 或
或.files/image351.gif) (2分,其他合理答案也可给分)
(2分,其他合理答案也可给分)
(2).files/image353.gif) (1分)
(1分).files/image355.gif) 第一步电离产生的
第一步电离产生的.files/image245.gif) 抑制了
抑制了.files/image346.gif) 的电离(2分)
的电离(2分)
32.(4分)(1)A (2分) (2)5:4 (2分)
33.(12分)(1).files/image112.gif) (2分) 受热分解生成
(2分) 受热分解生成.files/image360.gif) (2分) c点(2分)
(2分) c点(2分)
得到较高温度水蒸气(1),并排出装置中残留的空气,防止铁粉被氧化(1)
(2).files/image280.gif) ====
====.files/image363.gif) (2分)
(2分)
.files/image365.gif) =====
=====.files/image367.gif) (2分)
(2分)
七、(6分)34.(6分)(1)10:1(2分) (2)2(2分) (3)101:9 (2分)
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
A.C(s)+H2O(g)==CO(g)+H2(g):△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O(![]() )+8H2O(
)+8H2O(![]() )△H>0
)△H>0
C.CaC2(s)+2 H2O(![]() )==Ca(OH)2(s)+C2H2(g);△H<0
)==Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)==CO2(g)+2H2O(![]() ):△H<0
):△H<0
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
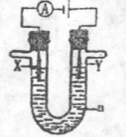 ②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为 mol。高☆考♂资♀源*网
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO?4溶液。
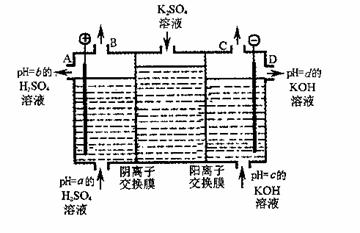 ① 该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
① 该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
查看习题详情和答案>>
(1)电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
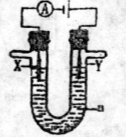
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中会生成白色固体,发生的总反应化学方程式为
。
该白色固体露置在空气中,可观察到的现象是
。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为 mol。高☆考♂资♀源*网
(2)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO??4溶液。
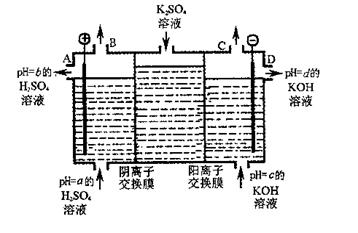
①该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B口与C口产生气体的质量比为 。
查看习题详情和答案>>I.如图是太阳光伏电池光电转换系统示意图,由图判断:
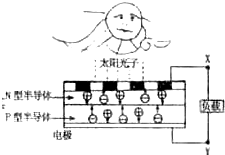
N型半导体是电池的
Ⅱ.下列观点符合科学道理的有:
A.核电站能把化学能转化为电能,应大力发展核能;
B.太阳光伏电池是把光能转换成电能的装置,其工作原理与原电池工作原理相同;
C.大量使用锂电池是开发环保新能源的举措;
D.氢氧燃料电池是一种绿色、环保、低碳的新能源;
Ⅲ.2010年全球锂离子电池总产量超过38亿只,回收废旧锂离子电池意义重大,其中需要重点回收利用的是正极材料,其主要成份有LiCoO2(钴酸锂),炭黑,铝箔等,某种回收流程如下:
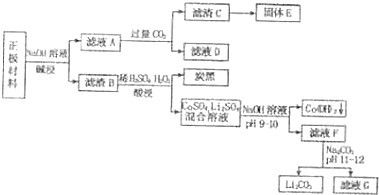
(1)碱浸时,正极材料中
(2)写出滤液A中通入过量CO2的离子方程式:
(3)酸浸发生反应的化学方程式是:
某课外活动小组同学用如图装置进行实验,试回答下列问题.

(1)若开始时开关K与a连接,则B极的电极反应式为________.
(2)若开始时开关K与b连接,则B极的电极反应式为________,总反应的离子方程式为________.
有关上述实验,下列说法正确的是(填序号)________.
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.

①该电解槽的阳极反应式为________.此时通过阴离子交换膜的离子数________(填“大于”或“小于”或“等于”)一通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)________导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因________.
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为________.
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于 ∶ 。 查看习题详情和答案>>