网址:http://m.1010jiajiao.com/timu_id_243574[举报]
题 号
1
2
3
4
5
6
7
8
9
答 案
D
D
B
C
C
D
C
B
B
题 号
10
11
12
13
14
15
16
17
答 案
A
C
D
B
D
B
B
A
18.(1)第三周期第VIA族(1分)
(2)CO2属于分子晶体而SiO2属于原子晶体(2分)
(3)NH3+HNO3 NH4NO3(2分)
(4)H2S、SiH4、C2H6、N2H4(写出3种即可)(3分)
 20
(10分 ) (每空2分)
20
(10分 ) (每空2分)
1、(NH4)2SO4 、 Ba(OH)2 + (NH4)2SO4 == BaSO4 + 2NH3↑+ 2H2O
2、AlO2-+ HCO3-==Al(OH)3↓+ CO2↑
3、Ca(HCO3)
21.(13分)
(1)① H2SO4(1分)。品红(1分);
生成的气体使品红褪色,并且加热后恢复红色,证明该产物是SO2 (2分)。

中学化学中有一类物质其氧化性强弱与物质的浓度有关,溶液的浓度不同时反应产物不相同。下列各组物质中具备上述性质的是 ( )
①Cu与HNO3溶液 ②Cu与FeC13溶液
③Zn与H2SO4溶液 ④Fe与HC1溶液
A.①② B.②③ C.③④ D.①③
查看习题详情和答案>>|
中学化学中有一类物质其氧化性强弱与物质的浓度有关,溶液的浓度不同时反应产物不相同.下列各组物质中具备上述性质的是 ①Cu与HNO3溶液 ②Cu与FeC13溶液 ③Zn与H2SO4溶液 ④Fe与HC1溶液 | |
A. |
①② |
B. |
②③ |
C. |
③④ |
D. |
①③ |
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长
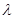 与光的频率v的关系为
与光的频率v的关系为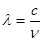 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
实验方法 | 实验现象 | 结论 |
分别向A、B溶液中加KSCN溶液 | ________ | 固体物质中有FeCl3 |
分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含_______ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:___________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是____________________________________________________________________。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为:_______________。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。方案2中铜作 极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_____________。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:________________。
查看习题详情和答案>>类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3,但当铁过量时,产物是 Fe (NO3) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2 。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12 中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。
探究过程如下:
提出假设: A 是 FeCl3 , B 是 FeCl2 。
(1) 设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | ____________________ | 固体物质中有FeCl3 |
| 分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含_______ |
(2)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:
____________________________________________________________。
(3)为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是_______________(填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeC13固体
(4)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,
某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。
该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
方案2 :在废液中加入适量的盐酸调节溶液的 pH = 1 ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________极,该电极上所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)______________________________________________________________。
方案2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:____________________________________
查看习题详情和答案>>