网址:http://m.1010jiajiao.com/timu_id_238597[举报]
一、(共69分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
A
D
D
C
D
C
B
B
A
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
B
C
A
C
A
B
A
B
D
C
二、(共15分)
24、A.Ⅰ⑴微量 儿童个头矮小、智力低下;甲状腺肿大、大脖子病等
⑵苯或四氯化碳等 ③⑥
⑶炒菜时不要先放盐或在烹饪快结束前再加入盐(每空1分,共5分)
Ⅱ⑷ C、H、O、N ⑸ C ⑹服用大量蛋清、牛奶或豆浆减缓毒性
⑺
 (每空1分,共5分)
(每空1分,共5分)
Ⅲ⑻Na+ Cl- 水体富营养化(或水华、赤潮等)(3分)
⑼2CaCO3+O2+2SO2=2CaSO4+2CO2(2分)
B.Ⅰ(每空2分,共8分)(1) 乙酸乙酯 (2) CH3COOH
(3)醛基 (4) CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
 ⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
三、(共16分)
25、(每空1分)
⑴ 第 2 周期 ⅠA 族
⑵A+D→B+C的离子方程式为 2Na+2H2O=2Na++2OH―+H2↑
G+I→H的离子方程式为 2Fe2++Cl2= 2Fe3++2Cl―
⑶ 溶液变成血红色 ⑷_____Ⅰ>Ⅲ>Ⅱ__
26.(1)不一定,因为碳酸银,硫酸银都是沉淀(2分) (2)NH4+ 0.8mol/L (2分)
(3)BaCO3 BaSO4 (2分)CO32- 0.04mol 、SO42- 0.02mol(2分)
(4)A(2分)
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有
 键的数目为____ __________________.
键的数目为____ __________________.②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18.则x=_________。常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为
 g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为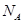 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含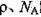 的计算式表示)
的计算式表示)
(4)下列有关的说法正确的是_____________。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
A.X是第ⅠA元素,Z是第ⅦA元素
B.X、Y、Z三种元素的最高化合价逐渐增大
C.Z的最高价氧化物对应的水化物是强酸
D.X、Z形成的化合物是离子化合物
查看习题详情和答案>>X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物强碱,Z的原子半径最小。据此判断下列说法不正确的是
A.X是第ⅠA元素,Z是第ⅦA元素 B.X、Y、Z三种元素的电负性逐渐减小
C.Z的最高价氧化物对应的水化物是强酸 D.X、Z形成的化合物是离子化合物
查看习题详情和答案>>