网址:http://m.1010jiajiao.com/timu_id_238582[举报]
一、(共69分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
A
D
D
C
D
C
B
B
A
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
B
C
A
C
A
B
A
B
D
C
二、(共15分)
24、A.Ⅰ⑴微量 儿童个头矮小、智力低下;甲状腺肿大、大脖子病等
⑵苯或四氯化碳等 ③⑥
⑶炒菜时不要先放盐或在烹饪快结束前再加入盐(每空1分,共5分)
Ⅱ⑷ C、H、O、N ⑸ C ⑹服用大量蛋清、牛奶或豆浆减缓毒性
⑺
 (每空1分,共5分)
(每空1分,共5分)
Ⅲ⑻Na+ Cl- 水体富营养化(或水华、赤潮等)(3分)
⑼2CaCO3+O2+2SO2=2CaSO4+2CO2(2分)
B.Ⅰ(每空2分,共8分)(1) 乙酸乙酯 (2) CH3COOH
(3)醛基 (4) CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
 ⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
三、(共16分)
25、(每空1分)
⑴ 第 2 周期 ⅠA 族
⑵A+D→B+C的离子方程式为 2Na+2H2O=2Na++2OH―+H2↑
G+I→H的离子方程式为 2Fe2++Cl2= 2Fe3++2Cl―
⑶ 溶液变成血红色 ⑷_____Ⅰ>Ⅲ>Ⅱ__
26.(1)不一定,因为碳酸银,硫酸银都是沉淀(2分) (2)NH4+ 0.8mol/L (2分)
(3)BaCO3 BaSO4 (2分)CO32- 0.04mol 、SO42- 0.02mol(2分)
(4)A(2分)
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):

(1)对于氢氧燃料电池中,下列表达不正确的是________
A.a电极是负极,OH-移向正极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g)
ΔH=-92.20 kJ·mol-1。
2NH3(g)
ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
|
时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
|
N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
|
H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
|
NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
查看习题详情和答案>>
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):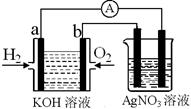
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向正极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)
 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。 查看习题详情和答案>>
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):

(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向正极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)
 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
Ⅰ、氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)
(1)对于氢氧燃料电池中,下列表达不正确的是______.
A、a电极是负极,OH-移向负极
B、b电极的电极反应为:O2+2H2O+4e-→4OH-
C、电极总反应式为:2H2+O2
| ||
D、电池中电解质溶液的pH保持不变
E、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)如图装置中盛有100mL 0.1mol?L-1 AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时右图装置中溶液的pH=______.(溶液体积变化忽略不计)
Ⅱ、氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1
(1)下列事实中,不能说明上述可逆反应已经达到平衡的是______.
①N2、H2、NH3的体积分数不再改变
②单位时间内生成2n mol NH3的同时生成3n mol H2
③单位时间内生成3n mol N-H键的同时生成n mol N≡N
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2.00L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为______kJ.
②0~1小时内N2的平均反应速率______mol?L-1?h-1
③此条件下该反应的化学平衡常数K=______(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向______方向移动(填“正反应”或“逆反应”或“不移动”)

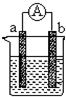 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能.现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用碱性溶液为电解液;则氢气应通入