摘要:2.展示经大家补充修改的方案.[讲述]同学们根据方案的要求将表格中的各项内容自己整理进行复习.[提示]这部分内容课前已布置预习作业.
网址:http://m.1010jiajiao.com/timu_id_233778[举报]
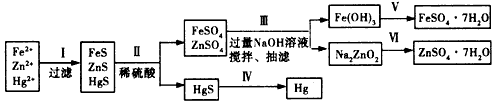
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
查看习题详情和答案>>
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
检查装置的气密性是化学实验中的重要操作之一.试按要求回答下列问题:
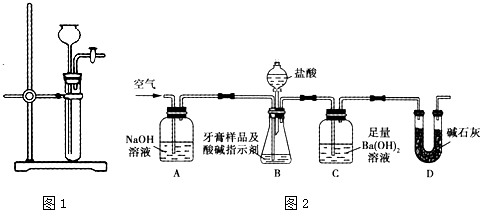
(1)为检查如图1所示简易气体发生装置的气密性,甲、乙两位同学分别进行了以下操作和方案设计.
①甲同学认为,只要往漏斗中加水,便可检查装置气密性是否良好.经检验
他的方案可行.则甲同学的操作方法、现象和结论是
②乙同学设计的方案:往漏斗中注入一定量的水至浸没长颈漏斗下端.关闭活塞,用手握住试管中上部,待漏斗中液面上升到一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中的液面低于试管中的液面且不再升降,说明装置的气密性良好.乙同学设计方案的原理是 .
(2)为检查如图2所示装置的气密性,应采取的方法是 .
查看习题详情和答案>>

(1)为检查如图1所示简易气体发生装置的气密性,甲、乙两位同学分别进行了以下操作和方案设计.
①甲同学认为,只要往漏斗中加水,便可检查装置气密性是否良好.经检验
他的方案可行.则甲同学的操作方法、现象和结论是
②乙同学设计的方案:往漏斗中注入一定量的水至浸没长颈漏斗下端.关闭活塞,用手握住试管中上部,待漏斗中液面上升到一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中的液面低于试管中的液面且不再升降,说明装置的气密性良好.乙同学设计方案的原理是
(2)为检查如图2所示装置的气密性,应采取的方法是
铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为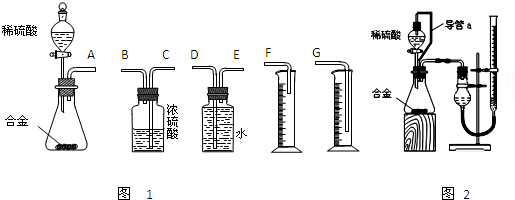
查看习题详情和答案>>
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥
97mL
97mL
.(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
偏高
偏高
(填“偏高”、“偏低”或“无影响”).【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接
E
E
接D
D
接G
G
(填接口字母,可不填满.)②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因
镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
.③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
ACD
ACD
.A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
.②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为
V1-V2
V1-V2
mL.
铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁30/0-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.
实验中发生反应的化学方程式是
【实验步骤】
(1)称取10.8g铝镁合金粉末样品,溶于VmL4.0mol?L-1'NaOH溶液中,充分反应.则NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
(1)同学们拟选用如图1所示实验装置完成实验:

你认为最简易的装置其连接顺序是:A接
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了如图3所示的实验装置.
①装置中导管a的作用是
②实验前后碱式滴定管中液面读数分别为V1mL、V2mL.则产生氢气的体积为
③若需确定产生氢气的量,还需测定的数据是:
查看习题详情和答案>>
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.
实验中发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【实验步骤】
(1)称取10.8g铝镁合金粉末样品,溶于VmL4.0mol?L-1'NaOH溶液中,充分反应.则NaOH溶液的体积V≥
97mL
97mL
.(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
偏高
偏高
(填“偏高”、“偏低”或“无影响”).【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
(1)同学们拟选用如图1所示实验装置完成实验:

你认为最简易的装置其连接顺序是:A接
E
E
接D
D
接G
G
(填接口字母,可不填满.)(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了如图3所示的实验装置.
①装置中导管a的作用是
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
.②实验前后碱式滴定管中液面读数分别为V1mL、V2mL.则产生氢气的体积为
V1-V2
V1-V2
mL.③若需确定产生氢气的量,还需测定的数据是:
温度
温度
,压强
压强
.
检查装置气密性是化学实验中的重要操作之一.试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是 (填序号,下同).
A、容量瓶 B、洗气瓶 C、分液漏斗 D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是 .
A、收集不到气体 B、造成环境污染 C、观察到的实验现象有误 D、引发爆炸事故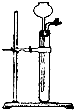
(3)为检查右图所示简易气体发生装置的气密性,甲、乙两位同学进行了以下操作和方案设计.
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好.经检验他的方案可行.则甲同学的操作方法、现象和结论是 .
②乙同学设计的方案是:往漏斗中注入一定量的水至浸没长颈漏头下端.关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好.乙同学设计方案的原理是 .
查看习题详情和答案>>
(1)下列仪器或装置在使用前一定要检查气密性的是
A、容量瓶 B、洗气瓶 C、分液漏斗 D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是
A、收集不到气体 B、造成环境污染 C、观察到的实验现象有误 D、引发爆炸事故

(3)为检查右图所示简易气体发生装置的气密性,甲、乙两位同学进行了以下操作和方案设计.
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好.经检验他的方案可行.则甲同学的操作方法、现象和结论是
②乙同学设计的方案是:往漏斗中注入一定量的水至浸没长颈漏头下端.关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好.乙同学设计方案的原理是