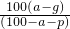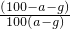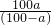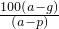摘要:(1)因为在20℃时.A的溶解度为10g.B的溶解度为20g.所以50gA和B的混合物溶于100g热水中.降温至20℃时.要使B不析出.A能析出.则在50g混合物中.B的质量应≤20g.A的质量应≥30g.即在50g混合物中B的质量分数应≤40%.</PGN0039.TXT/PGN>(2)中要使A析出.B不析出.必须满足的条件是什么?思考并回答:(2)要使B不析出.B的质量≤b.而A要析出.A的质量应>a.当W<a+b时.只要A>a.即可满足条件.所以A%>
网址:http://m.1010jiajiao.com/timu_id_233585[举报]
在20 ℃时,氯化钠的溶解度为36 g,取一定量该温度下的饱和氯化钠溶液用惰性电极进行电解。当阳极产生气体为11.2 L(标准状况)时,氯化钠完全电解,所得溶液的密度为1.2 g·mL-1。试计算:
(1)电解时所取饱和氯化钠溶液的质量。
(2)电解后溶液的物质的量浓度。
(3)要使溶液恢复原状态,需要加入多少克什么物质?
查看习题详情和答案>>在t℃时,取可溶物A其浓度为a%的溶液100g,蒸发掉p g水,冷却到t℃,析出A的不含结晶水的晶体g g,则在t℃时,A的溶解度为( )
查看习题详情和答案>>
A.
| B.
| ||||
C.
| D.
|
(2010?聊城一模)为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如图所示的实验装置.

(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2.已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是

(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)?SO2Cl2(l)△H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同.
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是
查看习题详情和答案>>

(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2.已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
防止倒吸
防止倒吸
;发生装置B应选择以下三种装置中的①
①
(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式
SO2+Cl2+2H2O=-4H++2Cl-+SO42-
SO2+Cl2+2H2O=-4H++2Cl-+SO42-
.(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在
BC
BC
装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂.(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)?SO2Cl2(l)△H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同.
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是
AC
AC
(填序号)A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是
AgCl
AgCl
.