网址:http://m.1010jiajiao.com/timu_id_233504[举报]
二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
|
实验步骤 (不要求写具体操作过程,仪器任选) |
预期的实验现象及结论 |
|
取适量的白色固体置于试管中,………… |
|
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:
查看习题详情和答案>>
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为 。
。
②平衡时氢气的浓度是 ,CO的平衡浓度是
,CO的平衡浓度是
 ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为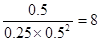 >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为

查看习题详情和答案>>
0.1mol某烃在氧气中完全燃烧,将生成物全部通入浓硫酸中,浓硫酸增重9g,继续通入足量的澄清石灰水中,得到沉淀50g.
求:(1)该有机化合物的分子式
(2)若分子中只有两个甲基且属于不饱和烃,写出其结构简式
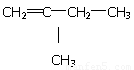
【解析】考查有机物分子式和结构式的判断。浓硫酸增重9g,说明生成物水是9g,物质的量是0.5mol。沉淀是碳酸钙,物质的量是0.5mol,则二氧化碳也是0.5mol。根据原子守恒可知分子式为C5H10。若属于不饱和烃,则是烯烃,分子中只有两个甲基,所以可能的结构简式是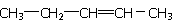 、
、 、
、 。
。
查看习题详情和答案>>
0.1mol某烃在氧气中完全燃烧,将生成物全部通入浓硫酸中,浓硫酸增重9g,继续通入足量的澄清石灰水中,得到沉淀50g.
求:(1)该有机化合物的分子式
(2)若分子中只有两个甲基且属于不饱和烃,写出其结构简式
【解析】考查有机物分子式和结构式的判断。浓硫酸增重9g,说明生成物水是9g,物质的量是0.5mol。沉淀是碳酸钙,物质的量是0.5mol,则二氧化碳也是0.5mol。根据原子守恒可知分子式为C5H10。若属于不饱和烃,则是烯烃,分子中只有两个甲基,所以可能的结构简式是、
、
。
查看习题详情和答案>>
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 molCH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为![]() 。
。
②平衡时氢气的浓度是![]() ,CO的平衡浓度是
,CO的平衡浓度是
![]() ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为![]() 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 molCH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为![]() >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为
查看习题详情和答案>>